2022年08月31日
新型コロナウイルスの感染を阻害するペプチドを発見 スパイクタンパク質の変異しにくい部位に作用し、種々の変異株にも効果がある阻害剤の開発に期待

概 要
国立研究開発法人 産業技術総合研究所(以下「産総研」という)バイオメディカル研究部門 山崎和彦主任研究員、久保田智巳主任研究員、同 細胞分子工学研究部門 舘野浩章研究グループ長、清水弘樹主任研究員、国立大学法人長崎大学感染症研究出島特区 森田公一教授、同 熱帯医学研究所 Ngwe Tun, Mya Myat准教授、高エネルギー加速器研究機構物質構造科学研究所 安達成彦特任准教授(研究当時)、川崎政人准教授、守屋俊夫特任准教授、池田聡人研究員は、新型コロナウイルスの従来株およびオミクロン株の感染阻害能を有するペプチド分子を発見しました。
このペプチドは、スパイクタンパク質上のN型糖鎖を認識して結合し、これを凝集させることによって、感染を阻害するという機能を持ちます。スパイクタンパク質中でも、糖鎖が付加される部位は変異を起こしにくいことが知られており、その結果、このペプチドの作用も変異に対して強いことが示されました。このペプチドを出発点として、これから生じる可能性のある新たな変異にも対応できる阻害剤の創出に貢献します。
なお、この技術の詳細は、2022年8月25日付で「The FEBS Journal」に掲載されました。
*下線部は【用語解説】参照
開発の社会的背景
国内における新型コロナウイルス感染症は、感染者数の増減の波を繰り返し、第7波は過去最大の感染者数を記録しています。複数回のワクチン接種によって重症化率が低く抑えられていますが、一方で、ウイルス変異により、接種したワクチンや認可を受けた抗体医薬品が効きにくくなることも明らかになっています。これは、抗体が標的とするスパイクタンパク質が変異を起こしやすいことに起因しており、変異によっては、今後再び深刻な状況に陥る危険性があります。対照的に、飲み薬にもできる低分子医薬品は、ウイルスのプロテアーゼやポリメラーゼを作用標的としており、比較的変異に強いことがわかっていますが、併用忌避剤が存在するなどの短所もあります。これらの低分子医薬品や抗体医薬品の一部はインフルエンザなど他のウイルス感染症治療薬やSARSの回復者の抗体をもとに、今回のパンデミックよりも前から開発が進められていました。すなわち、新型コロナウイルス感染症が近い未来に収束したとしても、治療薬開発を目指した研究を続けることは、次のパンデミックへの備えになると考えられます。
研究の経緯
産総研は、糖鎖認識タンパク質の糖鎖認識特異性や結合強度を網羅的に解析するシステムを開発し、医療への応用に取り組んできました。その中で、スギタケ由来の糖鎖結合ペプチド(Pholiota squarrosa lection: PhoSL)の単離同定に寄与するとともに、立体構造解析で糖鎖の特異的認識機構を解明しました。このペプチドは構成するアミノ酸40と少ないため、化学合成によって非天然型のアミノ酸を含む分子に容易に改変できる特長があります。また、海外の研究で、新型コロナウイルスのスパイクタンパク質上の糖鎖のうち約半数に、PhoSLが特異的に結合する構造(コアフコース)が見られることが明らかになっていました。
長崎大は、デングウイルスなど熱帯地方で問題となっているさまざまな高病原性ウイルスについて、ウイルス複製を中心とした分子機構の解析や病原性評価に取り組んできました。新型コロナウイルス感染症の拡大に伴い、感染阻害分子の活性評価も行っています。
高エネルギー加速器研究機構は、クライオ電子顕微鏡の共同利用拠点として、国内のユーザーと共に、生体高分子システムの立体構造解析を行っています。
今回、新型コロナウイルスのスパイクタンパク質とPhoSLの結合を定量的に解析し、結合によって凝集が生じることを観察し、そして、PhoSLが新型コロナウイルスの感染阻害能を有することを発見しました。
なお、本研究開発は、科学研究費補助金(基盤研究(B))「新規糖鎖標的プローブの創生による医療応用技術の開発(2018~2021年度)」、日本医療研究開発機構 創薬等先端技術支援基盤プラットフォーム(BINDS)による支援を受けています。
研究の内容
今回の発見は、N型糖鎖のコアフコース構造を特異的に認識するペプチド(PhoSL)が、新型コロナウイルスのスパイクタンパク質上の糖鎖に結合、凝集することで、ウイルスによる細胞感染を阻害することです。PhoSLの結合および感染阻害において、従来株とオミクロン株ともに同様の活性を示しました。
図1に、PhoSL三量体によるコアフコース糖鎖認識と、その結果生じるスパイクタンパク質との強い結合活性を示します。従来株およびオミクロン株由来のスパイクタンパク質ともに、解離定数として約4 nMと非常に強い結合活性が見られました。これは、PhoSLが糖鎖のみに結合する場合の約1000倍の活性となります。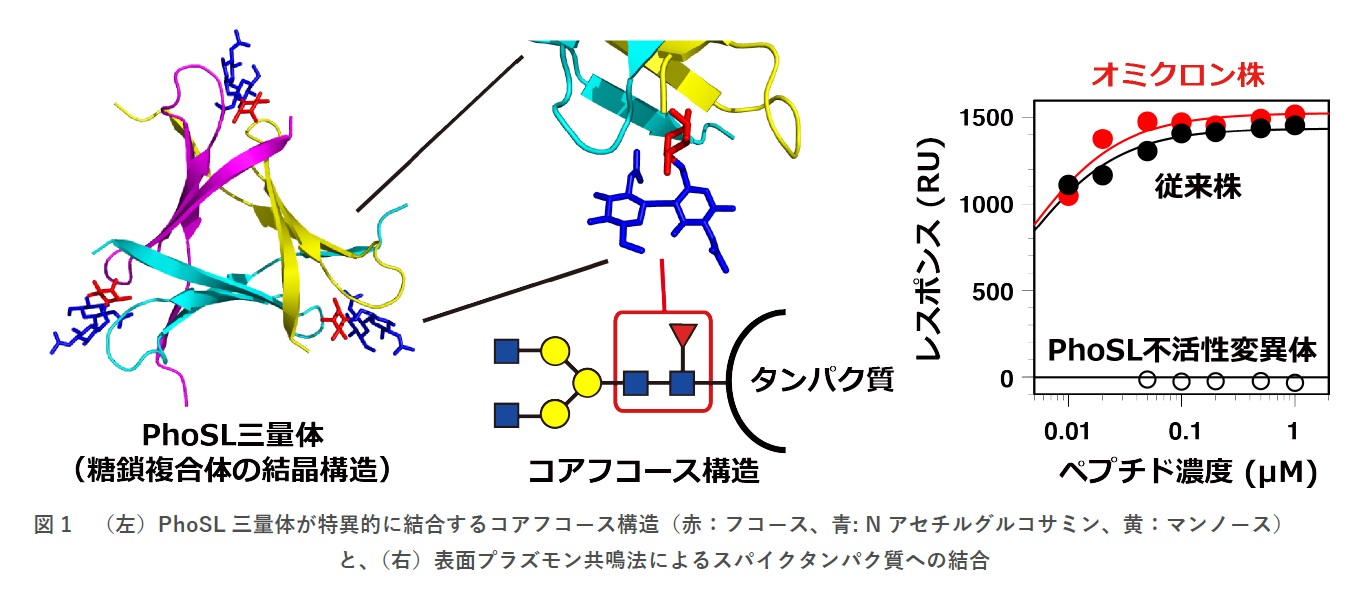
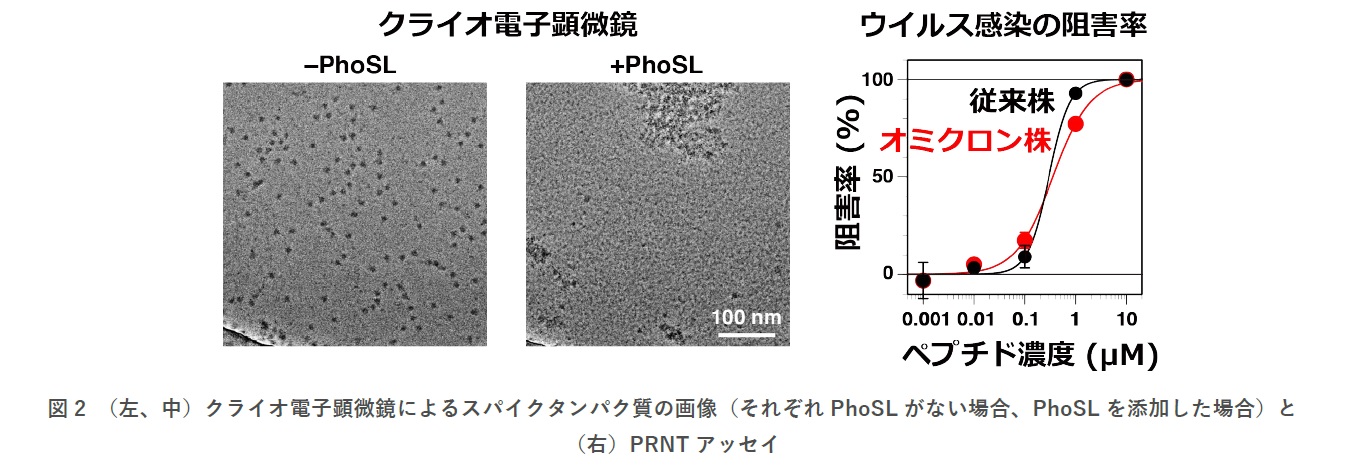
次に、クライオ電子顕微鏡で結合状態の観察を試みたところ、PhoSLがない場合はスパイクタンパク質の粒子が観察されるのに対し、PhoSLを添加した場合は顕著な凝集体を示すことがわかりました(図2)。そこで、霊長類培養細胞株を用いたPRNTアッセイを行ったところ、やはり従来株、オミクロン株ともに同程度の感染阻害活性が見られました。
 さらに、分子動力学計算によりPhoSLとスパイクタンパク質の相互作用のシミュレーションを行ったところ、スパイクタンパク質の糖鎖だけでなく、タンパク質部分とも相互作用していることがわかりました。これは、結合力が糖鎖だけの場合よりも強いことと関連すると考えられます。
さらに、分子動力学計算によりPhoSLとスパイクタンパク質の相互作用のシミュレーションを行ったところ、スパイクタンパク質の糖鎖だけでなく、タンパク質部分とも相互作用していることがわかりました。これは、結合力が糖鎖だけの場合よりも強いことと関連すると考えられます。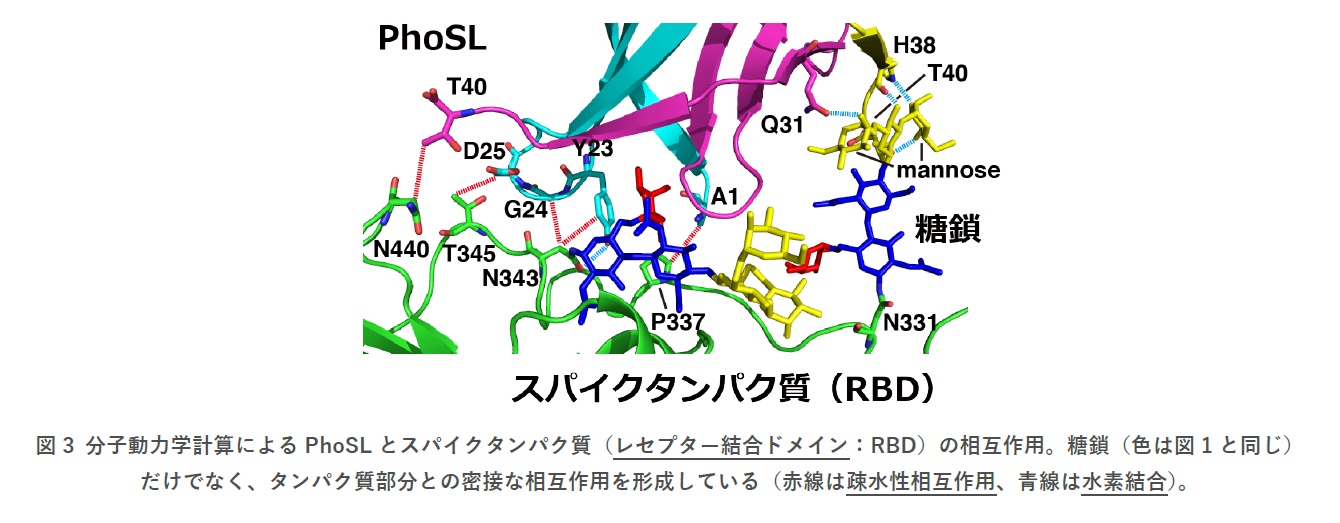
糖鎖付加の部位は変異しにくい傾向にあるため、糖鎖認識ペプチドであるPhoSLはさまざまな変異株に対して有効な広域スペクトラム阻害剤となることが期待できます。さらに、PhoSLに対して、非天然アミノ酸を含む改変によってタンパク質との相互作用を増強できれば、より強い阻害効果が得られることも期待できます。
※図1−3は原論文「Core fucose-specific Pholiota squarrosa lectin (PhoSL) as a potent broad-spectrum inhibitor of SARS-CoV-2 infection」の図を引用・改変したものを使用しています。
今後の予定
今後は、立体構造情報をもとにPhoSLを改変して、スパイクタンパク質との結合を増強し、感染阻害の活性を強化する予定です。これにより、PhoSLのウイルス感染に対する治療薬や診断薬としての活用を目指します。
論文情報
掲載誌:The FEBS Journal
論文タイトル:Core fucose-specific Pholiota squarrosa lectin (PhoSL) as a potent broad-spectrum inhibitor of SARS-CoV-2 infection
著者:山崎和彦、安達成彦、Ngwe Tun,Mya Myat、池田聡人、守屋俊夫、川崎政人、山崎智子、久保田智巳、長島生、清水弘樹、舘野浩章、森田公一
用語解説
スパイクタンパク質
ウイルス粒子の外殻に存在し、被感染細胞の受容体と結合して、ウイルスの侵入を引き起こすタンパク質。抗体のターゲットとなるが、ウイルスの変異によって構成するアミノ酸が変化しやすいことが知られています。三量体を形成します。
N型糖鎖
タンパク質を構成するアミノ酸のうちアスパラギンに付加される糖鎖の総称。新型コロナウイルスのスパイクタンパク質は1本鎖あたり22本のN型糖鎖(三量体あたり66本)が付加されています。
コアフコース
N型糖鎖のコア領域(3個のマンノースと2個のNアセチルグルコサミンからなる根元部分;図1左)の最も基部のNアセチルグルコサミンにフコースが付加された構造。主として、2個のNアセチルグルコサミンとフコースからなる3糖部分が認識されます。
クライオ電子顕微鏡
液体窒素温度で試料を凍らせて測定する電子顕微鏡法。基盤の面上でさまざまな角度に配置された分子の画像データを集めて3次元構造モデルを構築できます。本研究では高エネルギー加速器研究機構のクライオ電子顕微鏡を利用しました。
解離定数
結合の親和性の尺度で、値が小さいほど強いことを示します。1:1結合モデルにおいて、 [A][B]/[AB]([A]は分子A、[B]は分子B、[AB]は複合体の平衡状態での濃度)で表されます。
PRNTアッセイ
Plaque Reduction Neutralization Test。阻害物質の添加によって、ウイルス感染によって生じる培養細胞プレート上のプラーク数が減少する効果を評価する方法。
分子動力学計算
立体構造情報に基づいてニュートンの運動方程式を逐次解くことで分子の動きを計算する方法。
レセプター結合ドメイン
スパイクタンパク質の中で、被感染細胞の受容体(アンジオテンシン変換酵素2、ACE2)と結合する約200個のアミノ酸の領域。ここに変異が生じると受容体の特性が変わり、感染力が増強することがあります。2本のN型糖鎖が付加されており、ほとんどがコアフコース構造を有します。
疎水性相互作用と水素結合
生体高分子間の親和力の名称。前者は、脂質の間、後者は親水性分子の間の引き合う力に相当します。






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員