2023年04月27日
新たな骨の幹細胞「骨内膜幹細胞」を発見! 〜骨の再生に貢献する「光」、骨のがんを引き起こす「影」を併せ持つクリティカルな幹細胞 〜
長崎大学医歯薬学総合研究科の 松下 祐樹 准教授、米国テキサス大学の小野 法明 博士の研究グループは米国ミシガン大学などを含む国際共同研究によって、これまで同定されていなかった、骨髄に存在する新たな骨の幹細胞を発見し、「骨内膜幹細胞(Endosteal Stem Cells)」と名づけ、この新たな幹細胞が骨の成長や再生に貢献するとともに、がんの発生の起源にもなり得ることを明らかにしました。
体の成長に伴って骨が伸びたり、骨折の後に骨が元に戻るためには、骨髄に存在する骨の成長や再生を司る幹細胞が大きな役割を果たしていると以前から考えられていましたが、その存在は正確には明らかになっていませんでした。本研究では、小児期、成長期に当たる若齢マウスの大腿骨から幹細胞を含む全ての骨格系細胞を集め、シングルセル解析※2などデータサイエンスの手法を用いて幹細胞を推定し、さらに細胞運命追跡※3という手法により、骨髄に存在する新たな骨の幹細胞(=骨内膜幹細胞)を発見し、その運命を追跡することに成功しました。
その結果、今回新たに同定された骨内膜幹細胞は骨の成長、再生に大きく貢献する非常に重要な細胞であることが分かりました。一方で、がん抑制遺伝子p53※4の欠損により、骨肉腫※5という骨のがんを発生させる起源となることも明らかになりました。
この新たな骨の幹細胞の発見は、将来の骨再生療法への応用や、骨のがんである骨肉腫の病態解明、治療法の開発に貢献することが期待されます。
本研究成果は、英国の国際学術誌である「Nature Communications」に2023年4月25日に掲載されました。
■ポイント
● 体の成長に伴って骨が伸びたり、骨折後に骨が元に戻るために、骨の中(骨髄)に存在する骨の幹細胞※1が大きな役割を果たしていると以前から考えられていましたが、特に小児、成長期における骨の幹細胞の存在は明らかになっていませんでした。
● 小児期、成長期に当たる若齢マウスの大腿骨全ての骨格系細胞を集め、データサイエンスの力で幹細胞を推定し、その細胞の運命を実際に可視化、追跡することで、新たな骨の幹細胞を同定することに成功しました。
● この新たな幹細胞は骨の成長、再生に貢献する「光」の側面だけでなく、幹細胞自身ががん化して骨のがんを引き起こす「影」の側面を併せ持つクリティカルな細胞です。この発見は、将来的な再生医療やがん治療への応用など、さまざまな分野へ貢献することが期待されます。
■研究の背景
超高齢社会に突入し約15年が経過したわが国では今後もさらなる高齢化が進むと予想されており、2065年には国民の約2.6人に1人が65歳以上、約3.9人に1人が75歳以上になると推計されています。このような現代社会においては健康寿命を高めることが非常に重要な課題となりますが、加齢に伴う疾患の中でも、特に骨粗鬆症をはじめとする骨関連疾患は、それに起因する骨折により寝たきりに移行することもあり、健康寿命を縮める大きな要因となっています。また一方で、小児に目を向けても、骨の成長に異常をきたす疾患が数多く存在します。
骨はさまざまな機能を担う重要な器官であり、骨格として体を支え、運動機能を発揮すると同時に、血液を作る造血の場である骨髄を形成し、生命活動の維持に大きな貢献を果たしています。骨髄には多くの種類の細胞が存在しており、その中でも体の成長に伴って骨が伸びたり、骨折の後に骨が元通り治るためには、骨の幹細胞が大きな役割を果たしていると以前から考えられていました。しかし、これまでに生後、特に小児、成長期における、骨髄に存在する骨の幹細胞の存在は明らかになっておらず、再生医療などの臨床応用につなげていく上でも大きな障壁になっていました。
■研究の成果
本研究では、これまで未解明だった骨の成長期における新たな骨の幹細胞を同定することに成功しました。これまでに骨の幹細胞のみを単独で選び出すことはできませんでしたが、幹細胞を同定するためにまず、若齢マウスの大腿骨から幹細胞を含む全ての骨格系細胞(軟骨細胞、骨芽細胞、骨髄間質細胞、骨髄脂肪細胞、骨の幹細胞など、骨に関連する細胞の総称)を集め、シングルセル解析を行うことで、骨格系細胞全体の多様性を一細胞レベルで明らかにしました。さらにデータサイエンスの手法を活用することで、これらの骨格系細胞を形成する起源となる骨の幹細胞を含む集団を推定し、この細胞ではFgfr3(線維芽細胞増殖因子受容体3)※6という遺伝子の発現が強く認められることを確認しました(図1)。
図1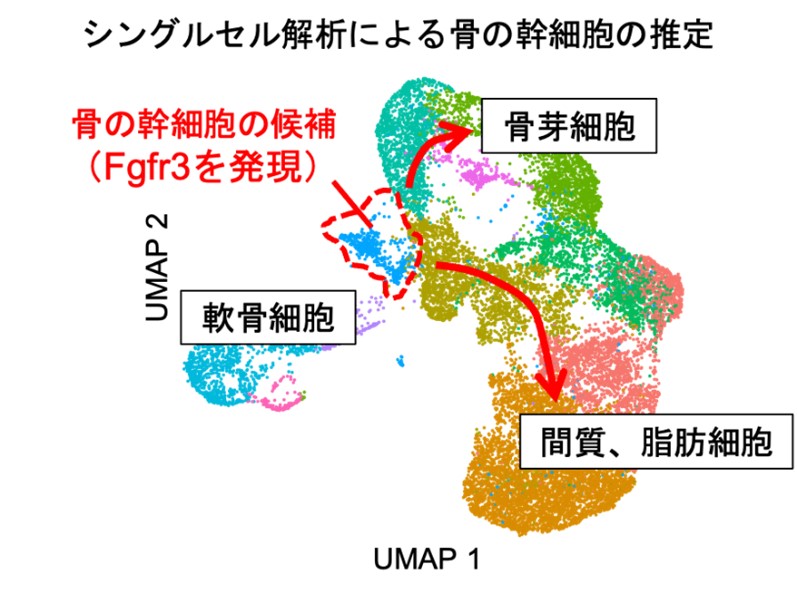 |
次に、データサイエンスにより幹細胞と推定されたこの細胞集団が、骨の中のどこに存在し、どのように骨の形成、再生に貢献するかを明らかにするために、細胞運命追跡という手法を用いて、Fgfr3を発現する細胞を赤色蛍光分子で可視化し、細胞の運命を追跡することに成功しました。Fgfr3を発現する細胞は、骨髄の内面の皮質骨に沿って並んでいる骨芽細胞に接するように存在していました。さらに細胞運命追跡や細胞培養などの解析によって、この細胞が何度も繰り返し増殖する自己複製能を持ちながら、軟骨、骨、脂肪に分化する多分化能を持つ骨の幹細胞であることを世界に先駆けて発見しました。本研究では、この新たに同定した骨の幹細胞を「骨内膜幹細胞(Endosteal stem cells)」 と名づけ(図2)、この幹細胞が小児期、成長期の骨の成長や骨の再生に大きく貢献することを明らかにしました。
図2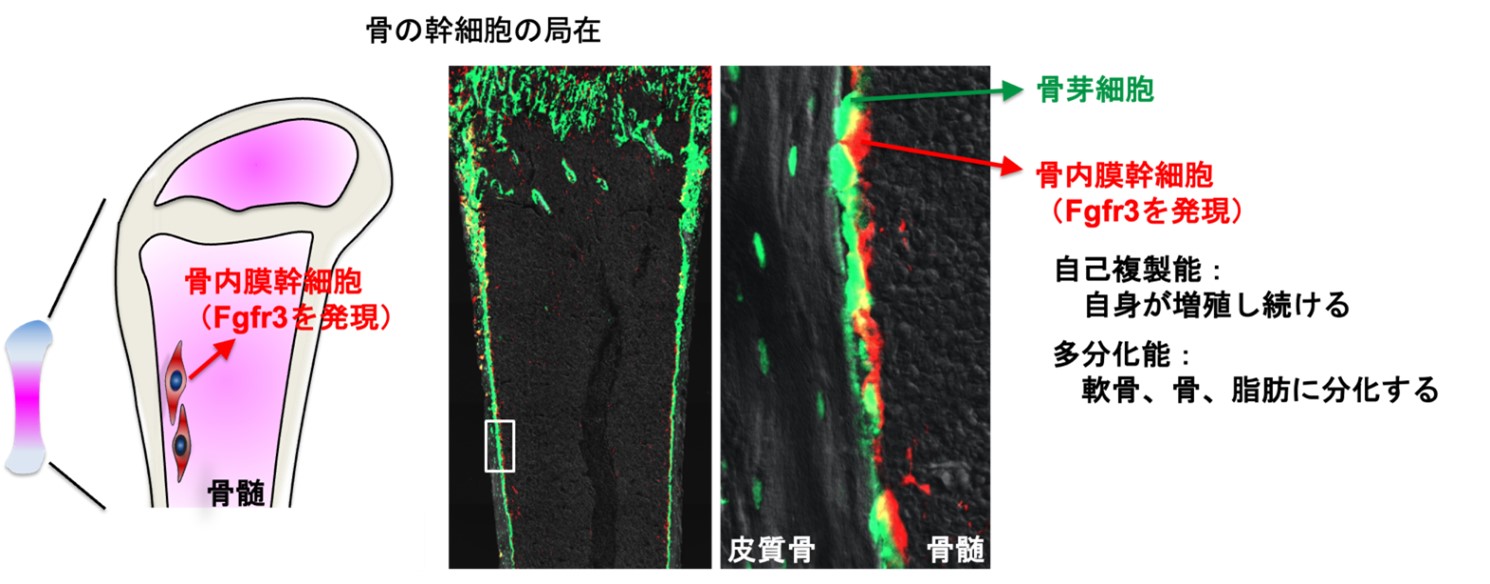 |
一方、以前より10代、20代の若年齢で発症しやすい骨のがんである骨肉腫の起源は骨の幹細胞である可能性が考えられていましたが、詳細は分かっていませんでした。そこで本研究では、この骨内膜幹細胞が骨肉腫を発生させる起源であるという仮説を立てました。骨肉腫ではほぼ全てのケースでがん抑制遺伝子であるp53の遺伝子変異が起こるため、本研究では骨内膜幹細胞に特異的にp53の機能を失うマウスを用いてさらに解析を進めました。すると100%の確率で非常に大きな骨肉腫様病変が発生し、骨内膜幹細胞は骨肉腫の起源であることが示唆されました(図3)。
図3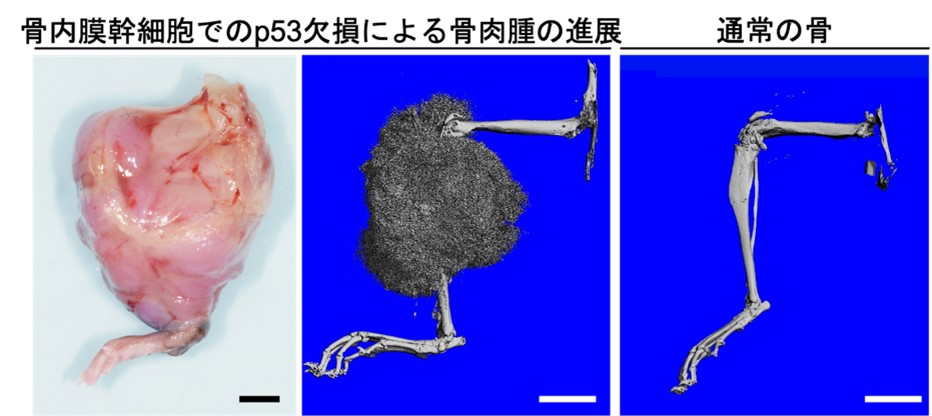 |
このことから、小児期、成長期における新たな骨の幹細胞である骨内膜幹細胞は骨の成長、再生に貢献する光の側面とともに、幹細胞自身ががん化して骨のがんを引き起こす影の側面を併せ持つ、非常に重要な細胞であることが分かりました。
■今後の展開、将来展望
この新たな骨の幹細胞の発見は、将来的な骨再生療法への応用や、骨のがんである骨肉腫の病態解明、治療法の開発に貢献することが期待されます。
▶用語解説
※1 骨の幹細胞:骨の成長、再生に大きく貢献し、さまざまな種類の骨格系細胞の起源となる細胞。自身が増殖し続ける自己複製能と、軟骨細胞、骨芽細胞、骨髄脂肪細胞などへの多分化能を併せ持つ。
※2 シングルセル解析:単一の細胞から網羅的に遺伝子発現解析を行う手法。
※3 細胞運命追跡:あるターゲットとする細胞集団の細胞運命を組織学的に追跡する手法。
※4 p53:細胞増殖を抑制する機能を持つ、がん抑制遺伝子。多くのがんにおいて高頻度で変異が認められる。
※5 骨肉腫:骨に発生するがん。10代、20代で発生しやすい。
※6 Fgfr3 (Fibroblast Growth Factor Receptor 3: 線維芽細胞増殖因子受容体3):FGFファミリータンパクと結合する膜貫通型の受容体タンパク。骨の成長期の骨内膜幹細胞で発現する。
■本研究プロジェクトについて
本研究は科学技術振興機構(JST)の創発的研究支援事業(JPMJFR2111)および日本学術振興会(JSPS)の科学研究費助成事業(JP21H03124)などの支援のもとで行われたものです。
■論文情報
題 名:Bone marrow endosteal stem cells dictate active osteogenesis and aggressive tumorigenesis
著 者:Yuki Matsushita1,2#, Jialin Liu3#, Angel Ka Yan Chu3, Chiaki Tsutsumi-Arai1, Mizuki Nagata1, Yuki Arai1, Wanida Ono1, Naoko Sakagami1, Kouhei Yamamoto4, Thomas L. Saunders5, Joshua D. Welch3*, Noriaki Ono1*
# First author
* Corresponding author
1.University of Texas Health Science Center at Houston School of Dentistry
2.Department of Cell Biology, Nagasaki University Graduate School of Biomedical Sciences
3.Department of Computational Medicine and Bioinformatics, University of Michigan
4.Department of Comprehensive Pathology, Tokyo Medical and Dental University
5.Transgenic Animal Model Core, University of Michigan Medical School
掲載誌:Nature Communications
DOI:10.1038/s41467-023-38034-2






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員