2023年07月06日
マラリア原虫とヒトの概日リズムの同調メカニズムを発見 ―発症の分子機構を阻害する、新規抗マラリア薬の開発に期待―
東京工業大学 科学技術創成研究院 化学生命科学研究所の小林勇気助教(研究当時。筆頭著者)、今村壮輔准教授(研究当時。現 日本電信電話株式会社(NTT) 宇宙環境エネルギー研究所 特別研究員)、田中寛教授(責任著者)、東京都医学総合研究所 細胞膜研究グループの小松谷啓介研究員(筆頭著者と同等貢献)、東京大学大学院 医学系研究科の野崎智義教授、渡邊洋一准教授、マレーシア・サバ大学の佐藤恵春准教授、イギリス・ジョンイネス研究所のAntony N. Dodd 教授、長崎大学大学院 熱帯医学・グローバルヘルス研究科の北潔教授らの研究グループは、ヒト体内で概日リズム(用語1)制御に関わるホルモンであるメラトニン(用語2)が、熱帯熱マラリア原虫(Plasmodium falciparum, 用語3)の増殖に必須で固有のゲノムを持つ細胞内小器官、アピコプラスト(用語4)における遺伝子発現を活性化することを発見した。私たちヒトは24 時間周期で振動する概日リズムを持ち、マラリア原虫も独自の概日リズムを持っている。しかし、感染前には別々に振動していた各々のリズムが、感染後に同調して周期的なマラリアの症状を引き起こす仕組みはこれまで理解されていなかった。今回の発見で、ヒトとマラリア原虫のリズム同調に関わるメカニズムの一つが明らかになり、この情報伝達のかく乱もしくは阻害による抗マラリア薬開発の可能性が示された。
この研究成果は、7 月3 日付の「Proceedings of National Academy of Sciences of UnitedStates of America(米国科学アカデミー紀要)」にWeb 掲載された。
■ポイント
○マラリア原虫が感染後、宿主ヒトの概日リズムと同期する仕組みを解明。
○マラリア原虫は血中メラトニンの感知により自身のリズムをヒトに同期させることを発見。
○マラリア発症の分子機構を標的とした、新規抗マラリア薬開発に期待。
■背 景
マラリアは蚊により媒介されるマラリア原虫により引き起こされる重篤な感染症であり、熱帯地域を中心に年に2億人以上が感染し、今でも数十万人の命が毎年マラリアにより失われている。そのため、マラリアの感染防止や治療は世界的に喫緊の課題となっている。マラリアに感染すると、患者は周期的な悪寒や発熱、頭痛や疲労感に苦しむことが知られている。患者さんに訪れるこの周期的な苦しみは、体内に入ったマラリア原虫の増殖周期が、ヒトの持つ概日リズムと同調し、体内で周期的に一斉に増殖することによる。この同調のメカニズムには、概日リズムを全身の細胞に伝える役割を持つ血中ホルモンであるメラトニンが関わるのではないかと考えられてきた。実際、ヒトとマラリア原虫のそれぞれが独自にもつ概日リズムを乱すと、感染したマラリア原虫の増殖や伝播が阻害されることがわかっている。すなわち、このようなリズムの発生やその同調に関する分子機構を理解することは、その分子を標的としたマラリア治療の開発につながる可能性がある。
■研究成果
アピコプラスト(図1)はマラリア原虫や近縁の寄生性原虫細胞内に見つかる細胞内小器官であり、マラリア原虫の増殖に必須な機能を有している。アピコプラストのゲノムにコードされた遺伝子の転写にはバクテリア型のRNA ポリメラーゼが関わっており、今回の研究では、このRNA ポリメラーゼの転写開始に必須なタンパク質であるシグマ因子(用語5)(ApSigma)が熱帯熱マラリア原虫の核ゲノムにコードされていることを発見した。また、メラトニンの存在がこの遺伝子の発現を活性化し、それに伴いアピコブラストゲノムにコードされる遺伝子の発現も活性化されることを明らかとした。すなわち、周期的に体内で生じるメラトニン分泌がスイッチとなり、そのタイミングでマラリア原虫が活性化するため、ヒトの概日リズムとマラリア原虫の活性周期が同調すると考えられる。
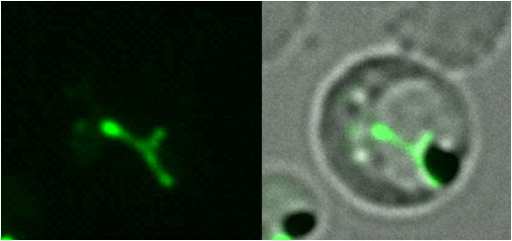 図1 GFP(緑色蛍光タンパク質)を発現させることでアピコプラスト(緑) を可視化した熱帯熱マラリア原虫の顕微鏡像 |
具体的な実験内容は、下記の通りである。まず、熱帯熱マラリア原虫をin-vitro(試験管内)のメラトニンのない環境で培養すると、核ゲノムやアピコプラストゲノムにコードされた遺伝子群は一定のリズムの下に発現する。ここにメラトニンを加えると、ApSigmaをコードする核遺伝子(apSig)の発現が上昇し、それに呼応してアピコプラストゲノムにコードされる遺伝子の発現上昇が観察された(図2)。
この結果は、ヒトの概日リズムが血中のホルモン(メラトニン)を介してアピコプラストの遺伝子発現に働きかけ、宿主ヒトとマラリア原虫の概日リズムの同調に関わることを示唆している。メラトニンの作用機作としては、マラリア原虫の表層にあるメラトニンレセプターで感知されたのち、細胞内セカンドメッセンジャーであるサイクリックAMP を介したシグナル伝達系によりapSig遺伝子発現を活性化していることが示された(図2)。
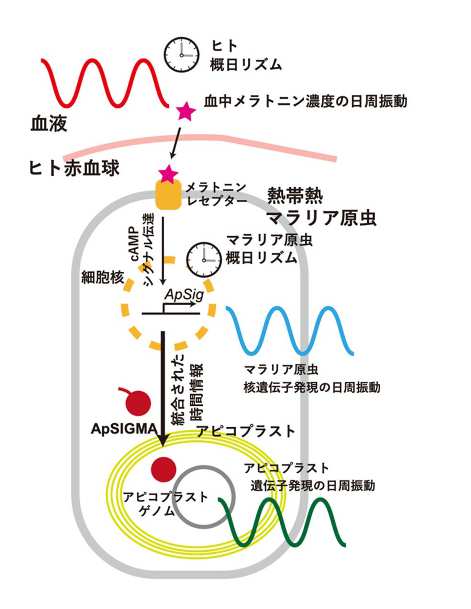 図2 宿主ヒトとマラリア原虫の概日リズムの統合メカニズム 図2 宿主ヒトとマラリア原虫の概日リズムの統合メカニズム |
■社会的インパクト
マラリア原虫が感染後、ヒトの概日リズムと同期して周期的なマラリアの症状を起こす仕組みの理解を深め、この制御系を標的にすることで新規抗マラリア薬が開発できる可能性がある。
■今後の展開
マラリア原虫のアピコプラストは固有のゲノムを持ち、イソプレノイドの合成など原虫の増殖に必須な機能を持っていることから、抗マラリア薬開発の標的として注目されてきた。マラリアの症状が周期的に起こることからも、宿主ヒトと原虫のリズムの同期は感染症の重篤性に深く関わる可能性が示唆されており、今回明らかとなったメカニズムの阻害は新規抗マラリア薬開発の標的候補となると考えられる。
■付 記
本研究は文科省/日本学術振興会 科学研究費助成事業(20K06638)、大隅科学技術創成財団研究助成、東京工業大学研究院WRHI プログラム、BBSRC (UK) Institute StrategicProgram 等のサポートにより実施された。
【参考情報】
植物の細胞も固有の概日リズムをもち、そのリズムは細胞核を中心とした分子機構で生成されており、葉緑体にその時間情報が伝えられる分子機構は長らく知られていなかった。2013 年に本論文の共著者でもあるAntony N. Dodd 博士を中心とした研究グループは、モデル植物シロイヌナズナでの核ゲノムにコードされる葉緑体シグマ因子SIG5遺伝子の発現が概日リズムに従って振動し、それにより時間情報が葉緑体に伝えられていることを証明した[参考文献]。このように、植物葉緑体と、そこから長い時間をかけて進化したマラリア原虫アピコプラストの両方で、概日リズムによる時間情報が核ゲノムコードのシグマ因子によりオルガネラに持ち込まれる分子機構が保存されていることは、その進化の観点からも非常に興味深い発見といえる。
【参考文献】
Noordally, Z. B. et al. Circadian Control of Chloroplast Transcription by aNuclear-Encoded Timing Signal. Science 339, 1316‒1319 (2013).
【用語説明】
(1) 概日リズム:多くの生物に内在する日周変動サイクルであり、約24 時間の周期をもつことから概日リズムと呼ばれる。
(2) メラトニン:体内の概日リズムに従って松果体で作られるホルモンであり、血中濃度の変動により整体リズム、睡眠や抗酸化活性の日周リズムをコントロールしていると考えられている。
(3) マラリア:マラリア原虫には三日熱マラリアを引き起こすPlasmodium vivax、四日熱マラリアを引き起こすPlasmodium malariae、卵形マラリアを引き起こすPlasmodium ovale、熱帯熱マラリアを引き起こすPlasmodium falciparumなどがあり、本研究で対象としているのは最も重篤なマラリアを引き起こす熱帯熱マラリア原虫である。
(4) アピコプラスト:マラリア原虫や近縁の寄生性原虫細胞内に見つかる四重膜に囲まれたオルガネラであり、その中に固有の環状ゲノムをもっている。このゲノム配列が真核藻類の葉緑体ゲノムと似ていることから、アピコプラストは藻類が別の真核細胞に内部共生した二次共生に由来すると考えられている。アピコプラストはイソプレノイドの合成など、マラリア原虫の増殖に必須の機能を果たしていることが知られている。
(5) シグマ因子:バクテリア型のRNA ポリメラーゼは3ないし4種のタンパク質からなるRNA 合成活性をもつコア酵素、およびコア酵素にプロモーターからの転写開始特異性を与えるシグマ因子からなっている。植物の葉緑体はシアノバクテリアの細胞内共生に由来するが、共生後、RNA ポリメラーゼ遺伝子のうちシグマ因子の遺伝子が核ゲノムに移行することで、細胞核が葉緑体転写をコントロールする制御構造が構築されたと考えられている。
【論文情報】
●掲載誌:Proceedings of the National Academy of Sciences of the United States of America
●論文タイトル:Coordination of apicoplast transcription in a malaria parasite by internaland host cues
●著 者:Yuki Kobayashia,1, Keisuke Komatsuyab,c,1, Sousuke Imamuraa,d, Tomoyoshi Nozakib,
Yoh-ichi Watanabeb, Shigeharu Satoa,e,f,g, Antony N. Doddh, Kiyoshi Kitab,g,I, Kan Tanakaa,*
●所 属:
a:Laboratory for Chemistry and Life Science, Institute of Innovative Research, Tokyo
Institute of Technology; Yokohama, 226-8503, Japan.
b:Department of Biomedical Chemistry, Graduate School of Medicine, The University of Tokyo; Tokyo, 113-0033,Japan.
c:Laboratory of Biomembrane, Tokyo Metropolitan Institute of Medical Science;Tokyo, 156-8506, Japan.
d:Space Environment and Energy Laboratories, Nippon Telegraph and Telephone Corporation; Tokyo, 180-8585, Japan.
e:Department of Pathology and Microbiology, Faculty of Medicine and Health Sciences, Universiti Malaysia Sabah; Sabah,88400, Malaysia.
f:Borneo Medical and Health Research Centre, Faculty of Medicine andHealth Sciences, Universiti Malaysia Sabah; Sabah, 88400, Malaysia.
g:School of TropicalMedicine and Global Health, Nagasaki University; Nagasaki, 852-8523, Japan.
h:Department of Cell and Developmental Biology, John Innes Centre; Norwich, NR4 7RU,
U.K.
i:Department of Host-Defense Biochemistry, Institute of Tropical Medicine, Nagasaki
University; Nagasaki, 852-8523, Japan.
1:These authors contributed equally.
●DOI:10.1073/pnas.2214765120






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員