2023年07月21日
マラリア創薬に向けた革新的ツールとなる遺伝子改変原虫を創出―複数のステージを標的とする新たな抗マラリア薬の開発に期待―
■概 要
本研究では抗マラリア薬開発に資する新たな遺伝子改変熱帯熱マラリア原虫を創出しました。この原虫はヒト・蚊二種類の宿主でGFP・NanoLucという二種類のレポータータンパク質を常に高いレベルで発現します。このふたつのレポータータンパク質の発現を利用することで、熱帯熱マラリア原虫を高感度で可視化、定量することに成功しました。さらにNanoLuc由来のシグナルを利用することで、ヒト・蚊二種類の宿主中での複数のステージに効果がある抗マラリア化合物の薬効を評価できることを実証しました。この抗マラリア化合物の評価系を利用して、大阪大学大学院薬学研究科から提供していただいた化合物ライブラリー1920個の中からヒト赤血球に寄生する熱帯熱マラリア原虫を殺す新しい化合物OU0074008を見つけることに成功しました。この研究によりNanoLucを発現する熱帯熱マラリア原虫を用いた創薬プラットフォームが抗マラリア薬開発を大きく前進させることが示唆されました。
本研究は、長崎大学熱帯医学研究所シオノギグローバル感染症連携部門の宮崎真也助教および宮崎幸子研究員(現所属:原虫学分野、助教)、稲岡健ダニエル准教授らの研究チームにより遂行されました。
また、本研究はオランダ、ライデン大学およびTropIQ、フランス、ソルボンヌ大学、大阪大学大学院薬学研究科との国際共同研究です。この研究成果は学術誌「Communications Biology誌」(doi: 10.1038/s42003-023-05078-5, Link: https://www.nature.com/articles/s42003-023-05078-5) に掲載されました。
■ポイント
●マラリア原虫はヒト・媒介蚊二種類の宿主に感染します。
●ヒト体内のステージと媒介蚊のステージ両方において、レポータータンパク質を高いレベルで発現する熱帯熱マラリア原虫を創出しました。
●創出したレポーター熱帯熱マラリア原虫を使ってヒト体内のステージ、蚊のステージ両方で抗マラリア化合物の評価ができることを実証しました。
●本成果に基づいて複数のステージに効果を示す新たな抗マラリア薬の開発が期待されます。
■研究の背景
マラリアはアフリカや東南アジアなどの熱帯地域で、蚊により媒介され甚大な数の感染者・死者を出す原虫感染症です。マラリア原虫がヒト赤血球の中で増殖することで、発熱、悪寒といったマラリアの症状が引き起こされます(赤内期)。一方で、ヒト赤血球内の一部の原虫はガメトサイト期と呼ばれるステージへと変化し、蚊の吸血により再び蚊の体内へと移行します。蚊の体内で増殖した原虫はスポロゾイトと呼ばれるステージへと変化し、再び蚊の刺咬によりヒト体内へと侵入します。感染したスポロゾイトはまずヒトの肝臓に感染しそこでの潜伏期を経た後にヒトの赤血球へと感染します。このように、マラリア原虫はヒトと蚊、ふたつの宿主に感染するための非常に巧みな寄生戦略を有しています(図1)。
マラリアの治療のために、赤血球内のマラリア原虫を殺すための治療薬が使用されてきました。しかし、既存の抗マラリア薬に対する耐性が出現していることから新たな作用機序を持つ抗マラリア薬の開発が望まれています。またマラリア原虫は蚊により媒介されるため、蚊の体内への伝播を阻止する薬剤(伝播阻止薬)がマラリアコントロールに重要だと考えられています。さらに、蚊の刺咬によりヒトに感染した後に肝臓の中に潜伏する期間があるため、肝臓内の原虫を殺すことができればマラリア発症を予防することができます。したがって、複数のステージに効果がある抗マラリア薬は、治療薬、予防薬、伝播阻止薬いずれの効果も示すことになるためマラリアコントロールに貢献することが期待されます(図1)。
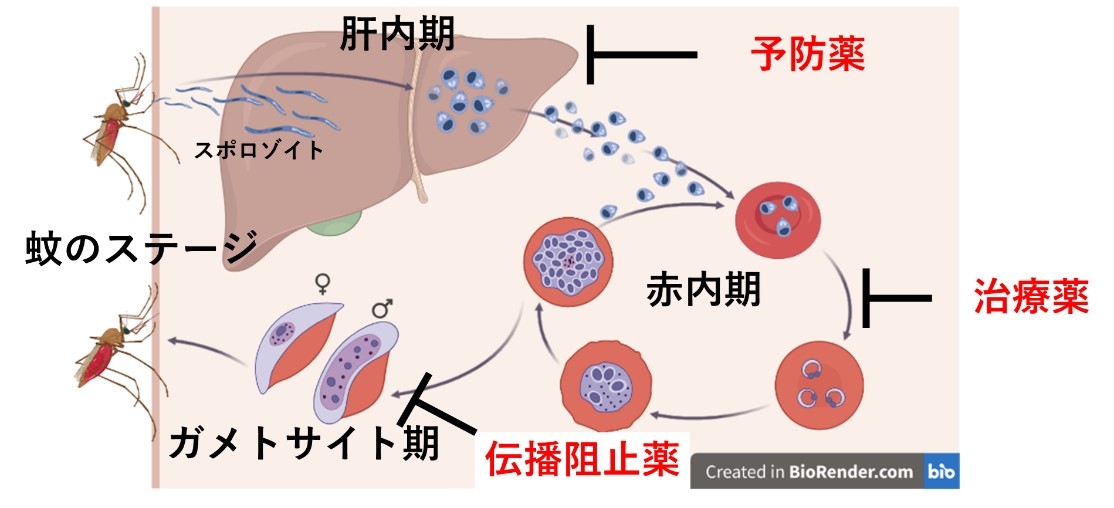 図1 熱帯熱マラリア原虫の生活環および求められている抗マラリア薬のモデル |
■研究の成果
本研究では熱帯熱マラリア原虫の遺伝子改変を行い蛍光タンパク質であるGFPおよびルシフェラーゼであるNanoLucを同時に発現させました。研究室で熱帯熱マラリア原虫の生活環を再現し、赤内期、ガメトサイト期、オーシスト期、スポロゾイト期、肝内期におけるGFPの発現を確認しました(図2)。本結果はGFP蛍光シグナルの顕微鏡観察により原虫の形態や数の観察が容易に行えることを示しています。
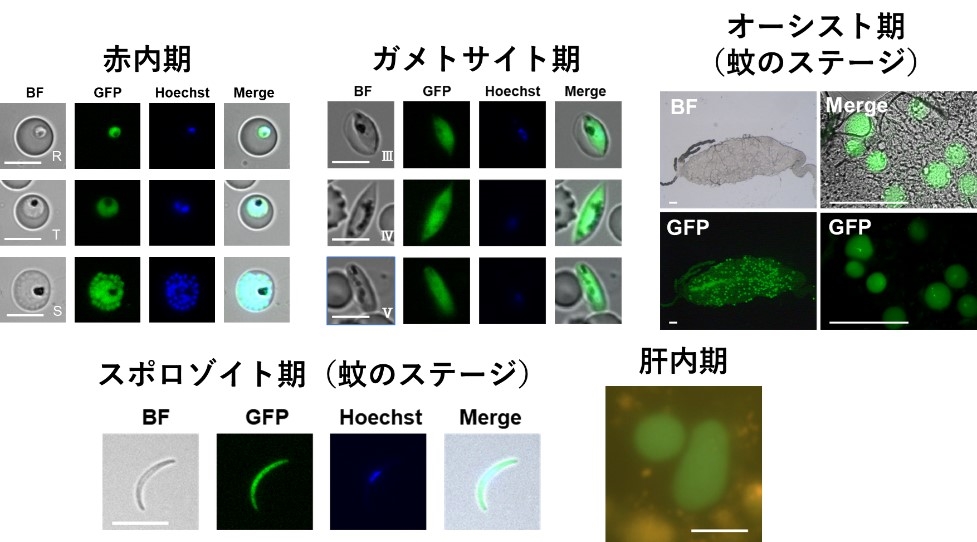 図2 様々なステージの熱帯熱マラリア原虫におけるGFP発現 |
続いて、GFPと同時に発現するNanoLucのシグナルを用いて抗マラリア薬の評価を行いました。赤内期の原虫を抗マラリア化合物が添加されたプレートに播種し、NanoLucのシグナルを検出することである化合物の増殖阻害活性を決定することができます。化合物の濃度が高くなるにつれて、原虫の増殖阻害の度合いも上昇していることが分かりました(図3)。このアッセイ系をガメトサイト期や肝内期にも適用しNanoLucシグナルを検出することで、赤内期のみならずガメトサイト期、肝内期での抗マラリア活性も評価できることを示しました。この一連の実験によりNanoLuc発現原虫を用いて複数ステージでの抗マラリア化合物の評価が可能であることが示唆されました。
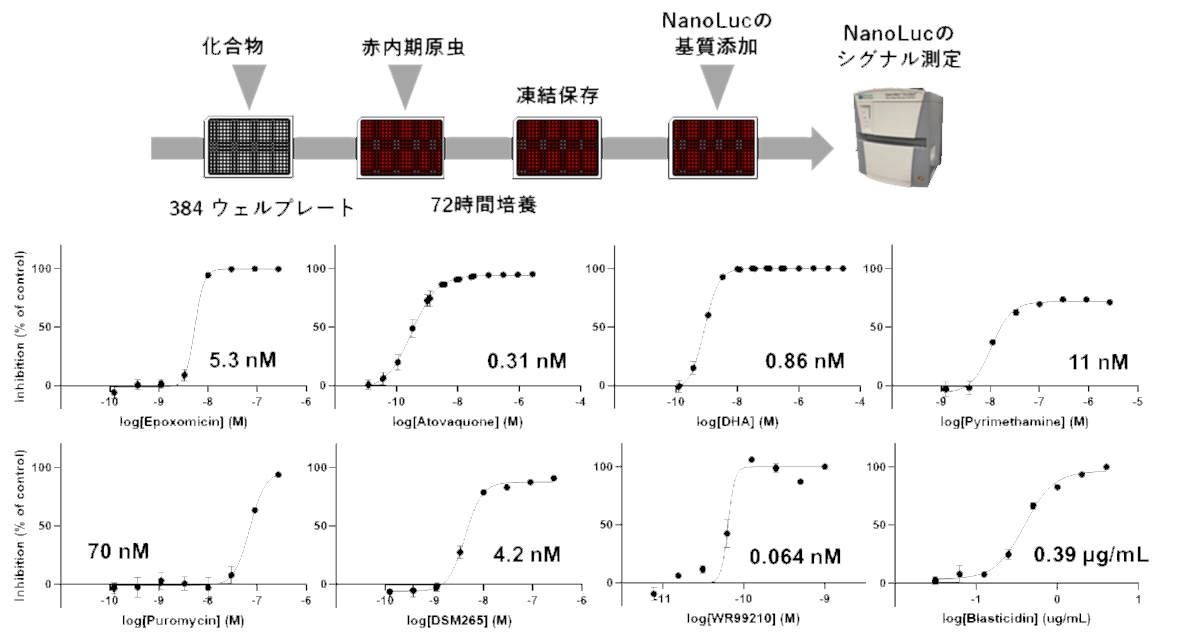 図3 NanoLuc発現原虫を使った赤内期原虫に対する抗マラリア薬評価 |
■今後の展開、将来展望
本研究では高感度なNanoLucをヒト・蚊ふたつの宿主内で発現する新しいレポーター熱帯熱マラリア原虫を創出し、新たな創薬プラットフォームを構築しました。複数のステージで発現するGFPやNanoLucのシグナルを利用することにより、創薬研究のみならずマラリア原虫そのものの基礎研究も大幅に推進することが期待されます。今後はNanoLuc発現原虫を用いた複数のステージの原虫の薬効評価を通して新たな抗マラリア薬開発へと展開します。
本研究で開発されたレポーターマラリア原虫は、リクエストに応じてアカデミアや創薬研究者の方への分与や共同研究が可能です。本レポーター原虫の使用に興味をお持ちになられた方は、ぜひ末尾の問い合わせ先にご連絡いただけましたら幸いです。
▶用語解説
マラリア
Plasmodium属の原虫により引き起こされる原虫感染症。ヒトにマラリアを引きおこすPlasmodium属原虫は複数種類が知られていますが、本研究ではヒトに最も重篤な症状を引き起こす熱帯熱マラリア原虫を対象としました。本原虫は媒介蚊の吸血によりヒトから蚊の体内へと移行し、蚊の体内で増殖した後に蚊の刺咬により再び他のヒトに感染します。そのため、ヒトと蚊というふたつの宿主の中の原虫の両方に効果がある薬が必要とされています。
蛍光タンパク質
緑色蛍光タンパク質 (Green fluorescent protein, GFP) に代表される蛍光を発するタンパク質。ある特定の波長の光を蛍光タンパク質に照射すると別の波長の蛍光が放出されます。特定の機械を使用し蛍光を検出することで蛍光タンパク質の細胞内の場所や量を調べることができます。
ルシフェラーゼ
ホタルルシフェラーゼに代表される酵素反応により発光するタンパク質。ルシフェラーゼが特定の発光物質と反応することで酵素反応が進行し特定の波長の光が放出されます。この放出された光の量を特定の機械で検出することでルシフェラーゼの量を測定することができます。今回の研究では小型かつ高感度なルシフェラーゼであるNanoLucを用いています。
■本研究プロジェクトについて
この場を借りて、本研究に関わってくださった全ての方に深く感謝申し上げます。本研究プロジェクトはEuropean Union's Horizon 2020 Research and Innovation, 文部科学省/日本学術振興会 科学研究費助成事業(課題番号:20K22767, 21K06994 and 22K15452)、日本医療研究開発機構 (AMED)(課題番号:JP22jk0210036 and JP22wm0325051)によりご支援いただきました。また本研究で使用した化合物ライブラリーは、AMED生命科学・創薬研究支援基盤事業(創薬等先端技術支援プラットフォーム(BINDS))課題番号JP22ama121054の支援(支援番号3361)によりご提供いただきました。
■論文情報
掲載誌:Communications Biology
論文タイトル:A versatile Plasmodium falciparum reporter line expressing NanoLuc enables highly sensitive multi-stage drug assays.
著 者:
Yukiko Miyazaki1,2*♰, Martijn W. Vos3, Fiona J.A. Geurten2, Pierre Bigeard4, Hans Kroeze2, Shohei Yoshioka5, Mitsuhiro Arisawa5, Daniel Ken Inaoka1,6,7, Valerie Soulard4, Koen J. Dechering3, Blandine Franke-Fayard2, Shinya Miyazaki2,8*
1 Department of Molecular Infection Dynamics, Institute of Tropical Medicine (NEKKEN), Nagasaki University, 852-8523, Nagasaki, Japan.
2 Department of Parasitology, Leiden University Medical Center, 2333 ZA, Leiden, The Netherlands.
3 TropIQ Health Sciences, Transistorweg 5, 6534 AT, Nijmegen, The Netherlands.
4 Sorbonne Université, Inserm, CNRS, Centre d'Immunologie et des Maladies Infectieuses, CIMI-Paris, F-75013 Paris, France.
5 Graduate School of Pharmaceutical Sciences, Osaka University, 565-0871, Osaka, Japan.
6 School of Tropical Medicine and Global Health, Nagasaki University, Nagasaki 852-8523, Japan.
7 Department of Biomedical Chemistry, Graduate School of Medicine, The University of Tokyo, Tokyo 113-0033, Japan.
8 Department of Cellular Architecture Studies, Institute of Tropical Medicine (NEKKEN), 852-8523, Nagasaki, Nagasaki University, Japan.
♰Present address: Department of Protozoology, Institute of Tropical Medicine (NEKKEN), Nagasaki University, Nagasaki, Japan.
DOI:10.1038/s42003-023-05078-5
Link: https://www.nature.com/articles/s42003-023-05078-5
*Corresponding author,
E-mail: y.miyazaki*nagasaki-u.ac.jp or smiyazaki*nagasaki-u.ac.jp
(*を@に変換して下さい)






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員