2023年09月20日
ナノ粒子を用いたmRNA(メッセンジャーRNA)型ワクチンのマウスモデルでの実証実験に世界で初めて成功マラリア感染早期の肝臓での原虫増殖を防ぐ~細胞性免疫が主役となるマラリアワクチンの実用化に期待~
本学熱帯医学研究所シオノギグローバル感染症連携部門免疫病態制御学分野の中前早百合特任研究員(現・臨床開発学分野助教)、水上修作准教授を中心としたグループは、mRNAを含むナノ粒子を用いたマウスへの免疫により、肝臓に留まり続ける記憶T細胞の誘導とこれによるマラリア感染の早期段階である肝細胞期での感染防御に成功しました。
■ポイント
・mRNAを含むナノ粒子(mRNA-containing lipid nanoparticle; mRNA-LNP)の投与で、肝臓に留まる
記憶T細胞(tissue-resident memory T cell; TRM)の誘導に成功しました。
・mRNA-LNPの投与で、マラリア感染の早期段階である肝細胞期マラリアに対する感染防御の誘導に成
功しました。
・細胞性免疫が主役になる新たなマラリアワクチンの開発が期待されます
■背 景
マラリアは、結核やHIV感染症とともに3大感染症に数えられる熱性疾患であり、蚊が媒介するマラリア原虫により引き起こされます。WHOによると2021年の感染件数は約2億4,700万件、死者数は約61万9,000人と推定されています。
原虫は、マラリア原虫に感染した蚊の唾液腺からスポロゾイト(その生活環において多様な形態をとるマラリア原虫がとる形態のひとつ)としてヒトの体内に侵入し、最初の標的臓器である肝臓(肝細胞)内で数万倍へと増殖します。感染後もここまでは症状を示すことはありません。その後、原虫は血流中に放出され、赤血球への感染と増殖及び感染赤血球の破壊を繰り返します(図1)。赤血球期のマラリアは様々な症状を呈し、その中には、発熱、悪寒、頭痛、関節痛など風邪でも認められるものも多いですが、意識障害(脳マラリア)や重症貧血など重篤な症状を引き起こすこともあり、最悪の場合死に至ります。マラリアに対しては多くのワクチン開発研究が行われています。しかしながら、臨床試験を終えWHOの推奨を受けたものは、現時点ではモスキリックス(RTS,S/AS01)ただひとつです。その効果は十分ではなく、より効果的なワクチンの開発は引き続き必要とされています。
ここで、感染症ワクチンと免疫の関係性について簡単にご説明します。ヒトの免疫は大きく自然免疫と獲得免疫の2つに分類されます。前者は病原体の侵入に対して迅速に反応できますが、免疫記憶を有しない(何回同じ病原体に感染しても反応までにかかる時間や強度は変わらない)という弱点が有ります。それに対して獲得免疫は、自然免疫よりも反応開始に時間を要しますが、記憶細胞の誘導により、同じ病原体に対する2度目の反応は初回と比べてより速くより強くなり、生体防御として大きな利益をもたらします。しかし、感染によって誘導される免疫記憶は、その強度・持続力ともに不十分なことが多く、また、初回感染が重篤な病態を引き起こすというリスクも有しています。そこで、感染症に対するワクチンは、初回感染の代わりにより安全な形で病原体の一部(弱毒化した病原体や病原体を構成するタンパク質などその形態は様々です)を投与することにより、免疫記憶の誘導を目指します。また、多くのワクチンは自然免疫を活性化する物質(アジュバント)も含んでおり、これによる免疫効果向上も図られています。
これまでの多くのマラリアワクチン開発研究では、獲得免疫の中でも液性免疫(産生された抗体が原虫の排除に働く免疫)の誘導に重きが置かれてきました。スポロゾイト期や赤血球期のように原虫に直接抗体が接触できる場合は良いのですが、抗体は細胞内に入ることは出来ないため、肝細胞期のように原虫が細胞内に潜んだ場合、これを攻撃できません。これに対して、液性免疫と獲得免疫の両輪をなす細胞性免疫(抗体ではなく免疫細胞が感染細胞を排除する免疫)において病原体の傷害に働く細胞傷害性T細胞(cytotoxic T lymphocyte; CTL)は、病原体が感染した細胞ごと殺すことが可能ですので、肝細胞期に対応する免疫反応として適しています(図1)。これまでもマラリア免疫における細胞性免疫の重要性は認識されていましたが、近年特に、肝臓に留まり続ける記憶T細胞(組織常在性記憶T細胞(tissue-resident memory T cell; TRM))の肝細胞期マラリアに対する感染防御における重要性が注目されています。一般的な免疫細胞は体内を循環しますので、局所に留まり続けるTRMの性質が組織を守るために大切な働きをしているのだと考えられています。マラリア特異的肝内TRMを増やすことが、マラリア原虫感染に対する防御に有効だと示唆する報告はこれまでにもありましたが、防御反応を引き起こすのに十分な肝内TRMの誘導は困難であると考えられていました。
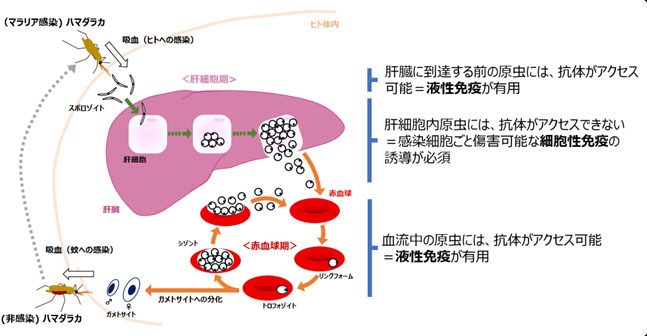 図1: マラリア原虫の生活環概要 |
■研究成果
本研究では、ワクチン投与による肝臓へのTRM誘導とそれによって引き起こされるマラリア原虫に対する感染防御効果をマウスのマラリアモデルで実証することを目指しました。免疫には、ワクチン候補となるタンパク質を発現させるためのmRNA配列を含み肝臓に指向性を持つ脂質ナノ粒子(mRNA-containing lipid nanoparticle; mRNA-LNP)を用いました。
まず、我々は、mRNA-LNPの筋肉内あるいは静脈内投与により肝臓優位なタンパク質発現が認められることを確認しました(図2)。次に、mRNA-LNPワクチンを用いた免疫が、脾臓と比べて肝臓に効率良くCTL及びTRM(図3)を誘導することを確かめました。
さらに我々は、このワクチンを投与したマウスにスポロゾイトを注入する感染実験を行いワクチン効果の検証を行いました。その結果、このmRNA-LNPワクチンが、確かに肝細胞内のマラリア原虫をほぼ完全に抑制することが明らかになりました。(図4)。
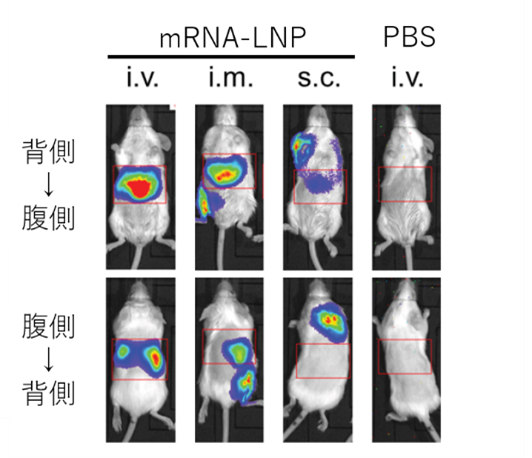 図2: mRNA-LNP投与により誘導された 図2: mRNA-LNP投与により誘導されたタンパク質の発現 いずれのmRNA-LNP投与経路でも上腹部 (別実験で肝臓と確認)に多くのタンパク質が 発現したことが分かりました。 |
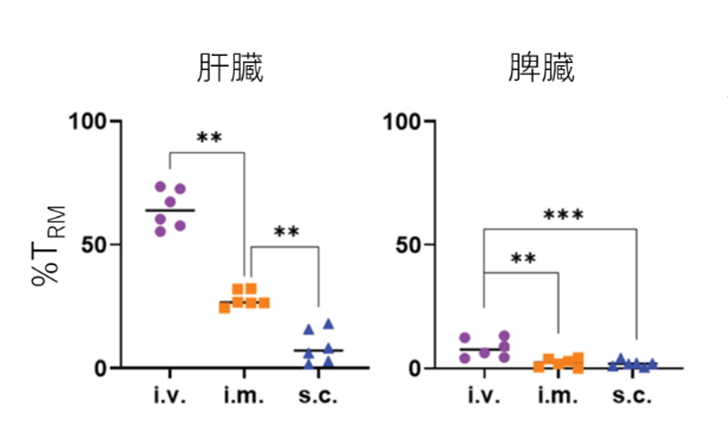 |
| 図3: 抗原特異的な細胞中のTRMの頻度 mRNA-LNP投与により、肝臓に高い頻度で TRMが認められることが分かりました。 |
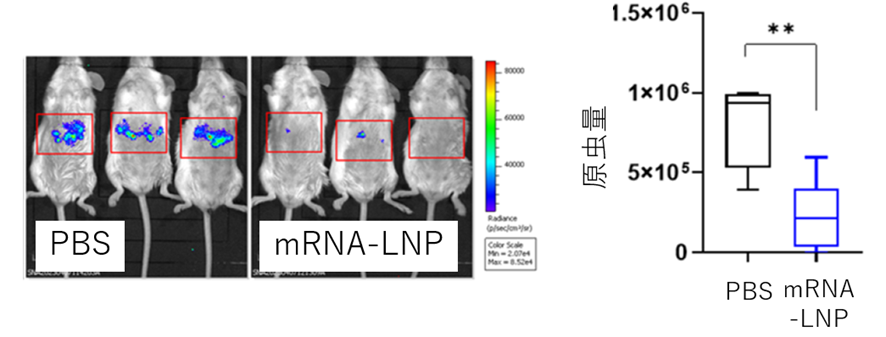 |
| 図4: mRNA-LNP投与により誘導された肝細胞期マラリアに対する防御効果の検討 mRNA-LNP投与により感染したマウスマラリアスポロゾイトの増殖が抑えられていることが 分かりました。 |
■実験方法などの補足
図2:ここでは、mRNA-LNP投与により発現するタンパク質の量や場所を確認するためにホタルのルシフェラーゼ酵素を発現させるmRNAを用いました。このmRNA-LNPの投与後にルシフェラーゼの基質であるルシフェリンを静脈内に投与し、mRNAにより生体内で作られた酵素量を酵素反応による発光量としてin vivo imaging system (IVIS)を用いて測定しました。用語:i.v.; 尾静脈投与, i.m.; 筋肉内投与, s.c.; 皮下投与, PBS; リン酸緩衝生理食塩水
図3:mRNA-LNPを投与したマウスの肝臓・脾臓を回収して、発現させたタンパク質に反応を示すT細胞及びそこに含まれるTRMの割合をフローサイトメトリーを用いた細胞解析により検討しました。ここでは、多くの研究で用いられている卵白アルブミン(Ovalbumin; OVA)タンパク質を発現させるmRNAを含むLNPを用いました。この実験からは、投与経路の違いが誘導されるTRM量に影響することも分かりました。
図4:ここでは、mRNA-LNP投与のあとにマウスマラリア原虫(P. berghei ANKA; PbA)のスポロゾイトをマウスに感染させ、肝細胞期のマラリア原虫量を免疫の有無で比較することにより、免疫効果を検討しました。その結果、mRNA-LNP免疫群(筋肉内投与)では、有意なマラリア原虫量減少が認められました。また、mRNAは多くのワクチン開発研究で用いられているPbAのスポロゾイト表面に発現しているタンパク質(circumsporozoite protein; CSP)を発現させるmRNAを用いました。この実験では、原虫検出を容易にするために、ルシフェラーゼを発現する原虫株を使用しました。また、細胞性免疫によるマラリア防御効果を検討するために、CSP mRNAからは抗体誘導に適しているとされる繰り返し配列部分を除いて使用しました。
■社会的インパクトと今後の展開
本研究によりマラリア感染防御における細胞性免疫(特に肝臓内の記憶T細胞(TRM))の重要性への理解が更に深まりました。また、mRNA-LNPを用いて感染防御に十分な細胞性免疫の誘導が可能であることが示されました。これにより、従来のワクチンよりも細胞性免疫に着目した新たなマラリアワクチン開発が期待されます。
■付 記
本研究は、国立大学法人長崎大学と塩野義製薬株式会社が2019年2月28日に締結した「マラリアを中心とした感染症分野における包括的連携」に関する協定に基づき、長崎大学熱帯医学研究所に共同研究部門設置された「シオノギグローバル感染症連携部門」にて主に実施されました。
本研究は、本学薬学部医薬品情報学分野(川上茂教授)、国立感染症研究所寄生動物部第3室(案浦健室長)らとの共同研究として行われました。
この研究成果は、8月23 日付で「Frontiers in Immunology」にWeb 掲載されました。
【補足説明】
(1) マラリア:ヒトにマラリアを引き起こすマラリア原虫には、Plasmodium falciparum, P. vivax, P. malariae, P. ovaleなどがあり、本研究で対象としているのは最も重篤化リスクの大きい熱帯熱マラリアを引き起こすP. falciparumです。
(2)mRNA封入脂質ナノ粒子:mRNAを含む脂質粒子であり、以前から次世代のワクチンプラットフォームとして注目されていましたが、COVID-19の大流行により新たなワクチンの形態として実用化されました。基本的に脂質としては、イオン化脂質、PEG化脂質、リン脂質、コレステロールの4種類が含まれますが、使用する脂質の種類や割合などは研究グループにより異なります。
(3) 組織常在性記憶T細胞(tissue resident memory T cell; TRM)
一般的な免疫細胞が体内を循環するのに対して、TRMは特定の臓器に留まり続けます。TRMは、誘導された際と同じ抗原(病原体など)を含む細胞に対峙すると、その傷害に働きます。肝内TRMの肝細胞期マラリアに対する防御免疫での重要性には、近年注目が集まっています。なお今回は、肝内のCD8陽性TRMについて報告を行いましたが、広義のTRMとしては、他の臓器特異的なものやCD4陽性(CD8陰性)のものも存在します。
【論文情報】
●掲載誌:Frontiers in Immunology
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1116299/full
●論文タイトル:Induction of liver-resident memory T cells and protection at liver-stage malaria by mRNA-containing lipid nanoparticles
●著 者:Sayuri Nakamae1†, Satoshi Miyagawa1,2†, Koki Ogawa3†, Mariko Kamiya3, Mayumi Taniguchi1, Akari Ono3, Maho Kawaguchi3, Awet Alem Teklemichael1, Jiun-Yu Jian1, Tamasa Araki4, Yukimi Katagami1, Hidefumi Mukai3, Takeshi Annoura4, Katsuyuki Yui5, Kenji Hirayama6, Shigeru Kawakami3, Shusaku Mizukami1,6*
●所 属:
1. Department of Immune Regulation, Shionogi Global Infectious Diseases Division, Institute of Tropical Medicine, Nagasaki University, Nagasaki, Nagasaki, Japan
2. Laboratory for Drug Discovery and Disease Research, SHIONOGI & CO., LTD., Osaka, Japan
3. Department of Pharmaceutical Informatics, Graduate School of Biomedical Sciences, Nagasaki University, Nagasaki, Nagasaki, Japan
4. Department of Parasitology, National Institute of Infectious Diseases, Shinjuku-ku, Tokyo, Japan
5. Shionogi Global Infectious Diseases Division, Institute of Tropical Medicine, Nagasaki University, Nagasaki, Nagasaki, Japan
6. School of Tropical Medicine and Global Health, Nagasaki University, Nagasaki, Nagasaki, Japan
* Corresponding author
† These authors contributed equally.






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員