2023年10月25日
マラリアの免疫記憶を量的質的にコントロールする方法を発見~ワクチン開発や、治療法開発における応用研究に期待~
長崎大学 熱帯医学研究所 シオノギグローバル感染症連携部門の由井克之特命教授らの研究グループは、マラリアの免疫記憶に関する動物モデルを使用した研究により以下の点を解明しました。
1、免疫応答に伴い感染初期に産生されるサイトカイン(※1)の一種、インターロイキン27が、
マラ リア原虫に対する感染抵抗性の獲得とその維持を抑制的に制御することを明らかにしました。
2、さらにマラリア原虫感染に際して、インターロイキン27は特定の記憶リンパ球の分化誘導を阻止
することを明らかにしました。
3、免疫応答の初期に産生されるインターロイキン27を人為的に制御することにより、免疫記憶を
量的質的にコントロールする可能性が示されました。今後のワクチン開発や、感染症に対する免疫応答
を強化する治療法開発への応用が期待されます。
■研究の背景
マラリアは、マラリア原虫の体内侵入と赤血球感染により引き起こされる感染症です。毎年多くの感染者と死者が報告されており、結核やエイズと並び、世界3大感染症のひとつに数えられています。
インフルエンザなど多くの感染症では、一度感染すると抵抗性を獲得し、同じ病原体に二度目はかかりにくい、あるいは感染しても軽症で治癒することが知られています。これは、病原体が体内に侵入すると、これを認識するリンパ球(白血球の一種)が増えると同時に病原体と戦う能力を増強し、免疫記憶細胞となって長期間体内に生存するためです。二回目の感染に際しては、この免疫記憶細胞が素早く反応し、病原体を排除します。ワクチンは、このことを利用して、感染なしで人為的に免疫記憶細胞を誘導するものです。
しかしながらマラリアでは、再感染に対する抵抗性を獲得しにくい、また一旦獲得した抵抗性が失われやすいと考えられています。そのため、何度も感染を繰り返したり、感染が遷延して慢性化したりするのです。マラリア原虫を認識するリンパ球が免疫記憶細胞になりにくいためだと考えられますが、その仕組みは十分に明らかではありませんでした。
■研究の成果
長崎大学 熱帯医学研究所 シオノギグローバル感染症連携部門の由井克之特命教授らの研究グループは、マラリアの免疫記憶について、インターロイキン27の免疫応答調節機構に着目し、動物モデルを用いて研究を進めてきました。インターロイキン27は、マラリア感染初期に免疫細胞により産生されます。インターロイキン27に対する抗体を投与することにより、この働きを感染初期限定的に抑制すると、慢性期において強力な感染防御免疫が長期間持続されることを明らかにしました(下部資料参照)。
さらに、その仕組みを詳細に調べると、通常では容易に認められないユニークなニ種類の記憶リンパ球が誘導されていました。これらのリンパ球は、長期間生存する免疫記憶細胞の性格と、マラリア原虫などを攻撃する機能的性格の両者を有しており、マラリアの再感染防御に重要な役割を担っていると考えられました。実際、感染初期にインターロイキン27に対する抗体で処理した動物は、慢性期のマラリア再感染に対して強い抵抗性を示しました。
■今後の展開と社会的インパクト
感染初期やワクチン投与に際して、免疫細胞によりサイトカインが産生されます。その中には、免疫応答を促進する働きを有するサイトカインもあれば、インターロイキン27のように免疫記憶の成立を抑制するサイトカインもあります。本研究は、免疫記憶を抑制するインターロイキン27の仕組みを明らかにし、今後のワクチン開発や、感染に対する抵抗性増強などの治療法開発において、インターロインキン27が新たな標的となり得ることを明らかにしました。今後の応用研究が期待されます。
※1 サイトカイン
主にタンパク質からできており、細胞から生産・分泌される物質で、ヒトでは数十種類知られている。
サイトカインは細胞同士の情報を伝達し、免疫細胞を活性化させたり抑制したりする働きを持っており、免疫機能のバランスを保つための重要な役割を担っている。インターロイキン27もサイトカインの一つ。
【参照資料】
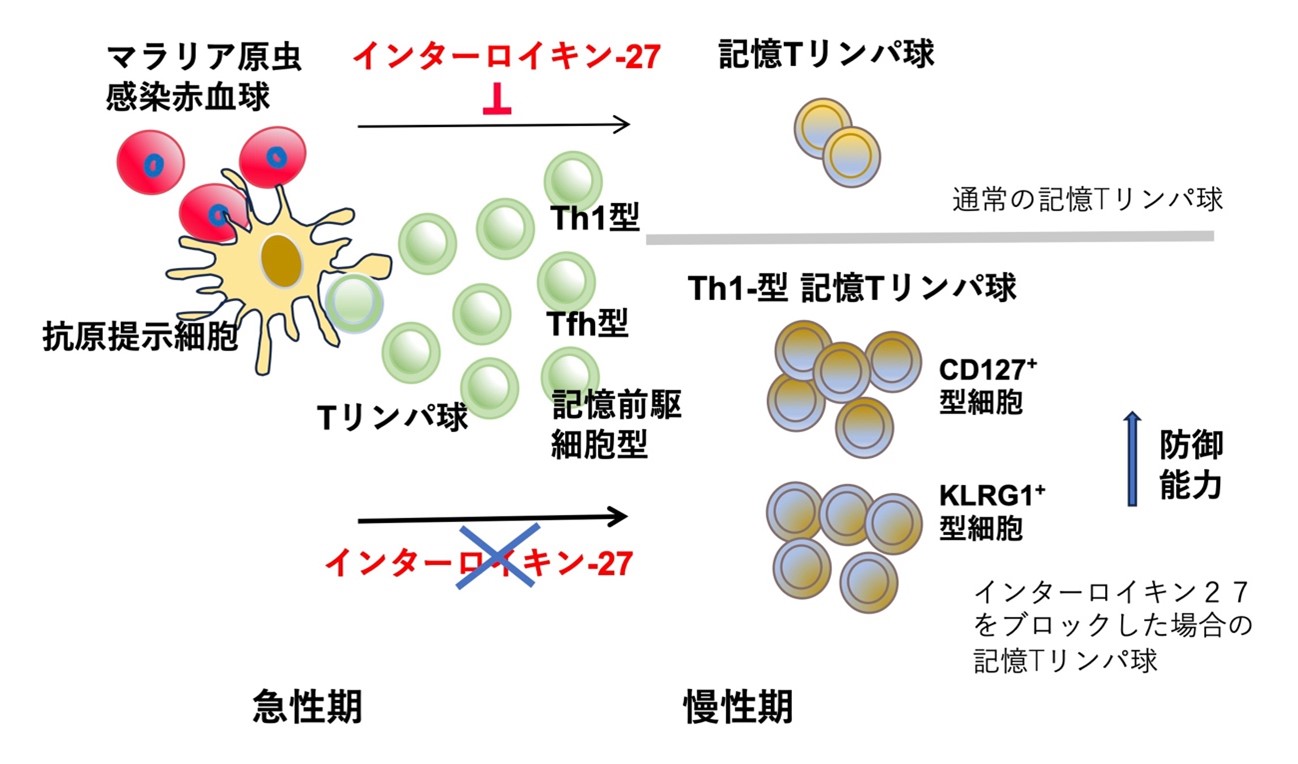 |
マラリア原虫は、赤血球に感染して種々の症状を現します。体内に侵入したマラリア原虫は、抗原提示細胞によって捉えられてTリンパ球に抗原提示されます。マラリア原虫を認識したTリンパ球は、抗原を認識して活性化され、1週間程度の間に増殖して数を増やすと共に、Th1型(主に細胞性免疫を促進するタイプ)やTfh型(主に抗体産生を促進するタイプ)など多様な感染防御能力を有する攻撃型Tリンパ球に分化します。これらの免疫応答により、マラリア原虫の増殖は抑制されることになります。これが感染急性期です。
急性期が過ぎると、体内ではマラリア原虫の増殖は抑えられ、低レベルで維持されるようになります。一方、マラリアを認識するリンパ球は記憶細胞となり、次のマラリア原虫の侵入や増殖に備えるようになります。これが慢性期です。
感染急性期には、活性化した免疫細胞によりインターロイキン27が産生されますが、これがリンパ球の記憶細胞への分化や記憶細胞の維持を抑制することを明らかにしました(本研究の成果のポイント1)。その結果、慢性期に維持される記憶細胞の数は多くありません。一方、急性期にインターロイキン27の働きをブロックすると、抑制が解除され、マラリア原虫感染防御能力の高い(Th1型)記憶リンパ球が数多く誘導・維持されます。また、この中にはCD127+型とKLRG1+型の2種類のユニークな記憶Tリンパ球があることが明らかになりました(本研究の成果のポイント2)。その結果、この動物は、マラリア原虫の再感染に対して高い防御能力を示すことができます。
本研究は、マラリア免疫記憶の脆弱性に原因として、インターロイキン27による免疫抑制の仕組みがあることを示しました。さらに、マラリアにとどまらず、様々なワクチン開発において、インターロイキン27の免疫抑制の仕組みを解除することにより、強力な免疫記憶を誘導・維持する可能性があることを示した点、画期的な研究成果だといえます(本研究の成果のポイント3)。
■論文情報
●掲載誌:EMBO Molecular Medicine
DOI: 10.15252/emmm.202317713
https://www.embopress.org/doi/10.15252/emmm.202317713
●論文タイトル:IL-27 produced during acute malaria infection regulates Plasmodium-specific memory CD4+ T cells
●著 者:Maria Lourdes Macalinao1, 2, Shin-Ichi Inoue3, Sanjaadorj Tsogtsaikhan3, Hirotaka Matsumoto4, Ganchimeg Bayarsaikhan3, Jiun-Yu Jian3, Kazumi Kimura3, Yoshiaki Yasumizu5, 6, Tsuyoshi Inoue7, Hiroki Yoshida8, Julius Hafalla2, Daisuke Kimura3, Katsuyuki Yui1, 3, 9, *
●所 属:
1 School of Tropical Medicine and Global Health, Nagasaki University, Nagasaki, 852-8523, Japan
2 Department of Infection Biology, Faculty of Infectious and Tropical Diseases, London School of Hygiene and Tropical Medicine, Keppel Street, London, WC1E7HT, UK
3 Division of Immunology, Department of Molecular Microbiology and Immunology, Graduate School of Biomedical Sciences, Nagasaki University, Nagasaki, 852-8523, Japan
4 School of Information and Data Sciences, Nagasaki University, Nagasaki, 852-8521, Japan
5 Department of Experimental Immunology, Immunology Frontier Research Center, Osaka University, Suita, Osaka, 565-0871, Japan
6 Integrated Frontier Research for Medical Science Division, Institute for Open and Transdisciplinary Research Initiatives (OTRI), Osaka University, Osaka, Japan.
7 Department of Physiology of Visceral Function and Body Fluid, Graduate School of Biomedical Sciences, Nagasaki University, 852-8523, Japan
8 Division of Molecular and Cellular Immunoscience, Department of Biomolecular Sciences, Faculty of Medicine, Saga University, Saga, 849-8501, Japan
9 Shionogi Global Infectious Diseases Division, Institute of Tropical Medicine, Nagasaki University, Nagasaki, 852-8523, Japan
* Corresponding author.






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員