2023年12月04日
核酸医薬品の大きな課題となっていた副作用を熱力学を応用して低減することに成功
長崎大学 薬学部 機能性分子化学分野の山本剛史准教授らの研究グループは熱力学を応用し、核酸医薬品の副作用を低減することに成功しました。
DNAやRNAなどの核酸分子から作られる医薬品を「核酸医薬」と呼びます。核酸医薬は、原理的には、希少疾患や難治性疾患からより一般的な病気に至るまで、多くの患者さんの治療薬の選択肢になりうる医薬品(技術)ですが、技術的な問題や、副作用が課題となり、まだ広い普及には至っていません。今回の研究で考案されたBROTHERS技術では、大きな課題となっていた副作用を低減することに成功しており、今後は幅広い疾患への実用化が期待され、治療薬開発が進められています。
■研究成果のポイント
●核酸医薬の副作用は、核酸医薬に対して、生命活動に重要なタンパク質やRNAなどの生体分子が結合・吸着し、細胞内の生命活動の一部が破綻することにより引き起こされると考えられています。
●そこで、研究グループでは、核酸医薬の副作用の課題を解決するため、熱力学原理とナノテクノロジーを応用した分子装置(BROTHERS構造体)を考案しました(図1)。
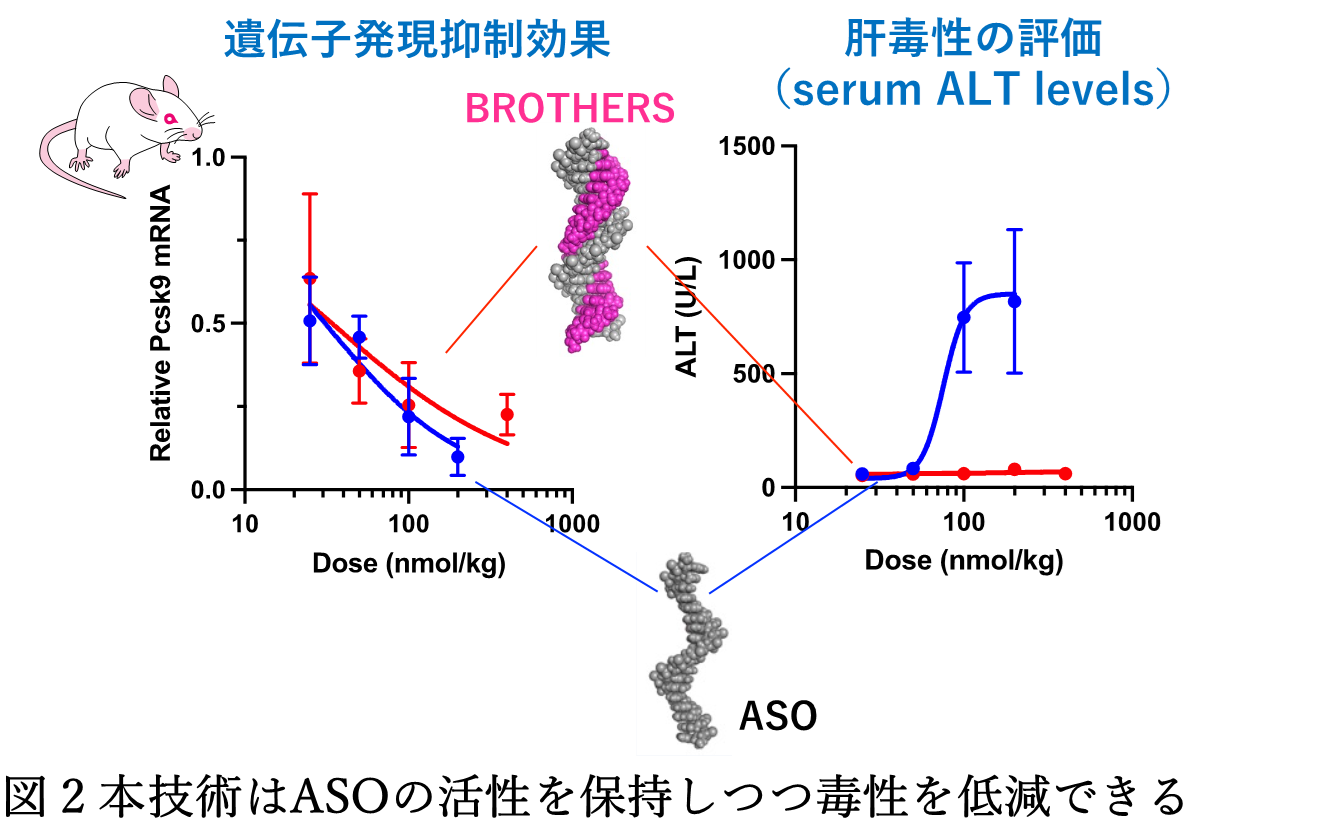
●このBROTHERS構造体は、核酸医薬が生体分子に発見されないように「不可視」な状態で狙いの遺伝子を探し出し、薬効を発揮するようプログラムされています。実験でも、問題であった生体分子の吸着現象を回避し、副作用の低減につながることが示されました(図2)。
●本研究成果は、英国科学誌「Nature Communications」に掲載されました(2023年11月2日)。
●現在、BROTHERS技術をベンチャー企業に導出し、本技術に基づく治療薬の開発を精力的に進めています。
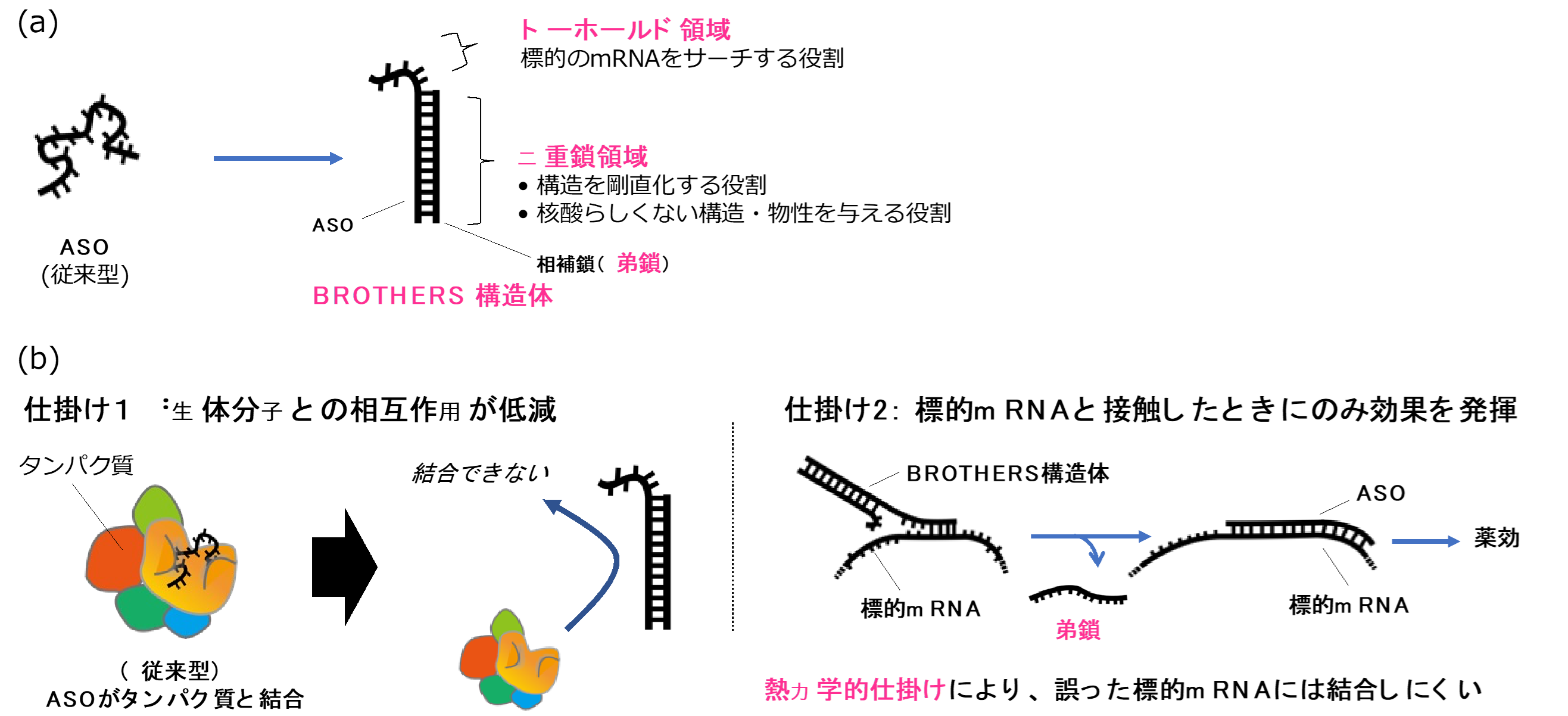
図 1 BROTHERS技術の概要(a)弟鎖を用いたASOのBROTHERS化戦略、
(b)BROTHERS技術により生体不可視化(仕掛け1)と標的mRNA応答型の活性化(仕掛け2)を実現
■研究成果の詳細
背景・着想の経緯:核酸医薬は、核酸分子が複数連なった構造を持ち、その並び方(塩基配列)を変えるだけで様々な疾患の治療に応用できるという点で、非常に汎用性が高い創薬技術です。核酸医薬には、mRNAワクチンに代表される長鎖構造を持つものや、アンチセンス核酸(ASO)やsiRNAなどの短い配列のものなど多様な様態がこれまでに開発されています。とりわけ、ASOは1970年代後半にその可能性が見出されて以来、非常に長い開発の歴史を持つ核酸医薬です。この間に、様々な改良が加えられ、ようやく最近になって希少疾患に対する治療薬として承認される品目が増えてきたものの、その副作用の課題から未だ広い普及には至っていません。
現在、ASOの副作用の主たる起源はオフターゲット効果(注1)であるとする考え方が主流となっています。オフターゲット効果は、ASO分子が本来の薬剤標的分子以外の分子と結合(相互作用)してしまうことで引き起こされます。どのような分子との結合が副作用を引き起こすかに関する様々な研究が進められてきましたが、特定できておらず、そのため副作用を回避するための有効な手段の開発も進んでいませんでした。
しかし、そもそも核酸は、我々の生命の根幹をなす最も大事な分子であって、多くの生体分子が核酸と結合するように進化してきています。核酸医薬が核酸と見間違えられ、タンパク質やRNAなどの様々な生体分子が核酸医薬に結合してしまうのは当然のことなのではないか?と初心にかえったことがきっかけで、今回の副作用回避技術の着想につながりました。
研究成果:具体的には、生体内の数多の核酸センサーからのがれるためのアーキテクチャ(構造体)を構築するというアイデアです。ASO分子に対して、天然には存在しない「人工核酸」をあらかじめ相補鎖(注2)として結合させておくことで、今回これを実現しました(図1a)。すなわち、このBROTHERS構造体と我々が呼ぶ複合体は、天然の核酸分子とは似つかぬ姿(= 構造・物性)をしており、生体内でほとんど見つかることなく(= 生体分子と強い相互作用をせず)病巣へ侵入し、本来の標的遺伝子に出会ったときに初めて核酸医薬としての薬効を発揮することができます(図1b)。これまで課題であった、似た塩基配列を持つ遺伝子へのオフターゲット作用も大幅に減弱できることを示しました。
ASOに上述の性質を組み込むために、熱力学の原理とナノテクノロジーの技術を応用しました。すなわち、BROTHERS構造体の自由エネルギーを評価し熱力学的安定性を最適化するとともに、反応速度を司る活性化エネルギーの最適化を行うことで、BROTHERS構造体を標的遺伝子に”タッチ”した(触れた)ときのみにASOが姿を現し薬効を発揮できるインテリジェントな分子装置に仕上げました。一般に、ASOを複合体にすると薬効が失われてしまうことが知られていますが、「熱」を操ることで薬効を維持したまま副作用を取り去ることを可能としました(図2)。
|
展望:BROTHERS技術は、ASOの最大の課題であった副作用の課題を克服するものであり、広い疾患への実用化が期待されます。本技術は、国立循環器病センター発の創薬ベンチャーであるリードファーマ株式会社に導出が完了しており、現在、治療薬開発が進められています。 |
 |
■謝 辞
本研究は、長崎大学のBun Chan助教、大山要教授、山吉麻子教授、東北大学の和田健彦教授、国立循環器病研究センターの斯波真理子部長らとの共同で実施したものです。本研究は、日本学術振興会(JSPS)科学研究費助成事業(課題番号:22H02783、20H05874、JP22KJ2503・JP22J20853)、橋渡し研究戦略的推進プログラム九州大学拠点(課題番号:A206、A257)、「物質・デバイス領域共同研究拠点」共同研究プログラム(課題番号:20221234、20211123、20201156)の助成を受け実施されました。このプロジェクトにご賛同いただきましたこと、この場を借りて厚く御礼申し上げます。
■論文情報
掲載誌: Nature Communications
論文タイトル: Dynamic and static control of the off-target interactions of antisense oligonucleotides using toehold chemistry
著 者: Chisato Terada, Kaho Oh, Ryutaro Tsubaki, Bun Chan, Nozomi Aibara, Kaname Ohyama, Masa-Aki Shibata, Takehiko Wada, Mariko Harada-Shiba, Asako Yamayoshi, Tsuyoshi Yamamoto
DOI: https://doi.org/10.1038/s41467-023-43714-0
Published: 02 December 2023
【用語解説】
(注1) オフターゲット効果
核酸医薬が本来標的とする遺伝子の発現を抑制したときに起こる効果(有効性や副作用)以外のメカニズムで引き起こされる効果(有効性や副作用)のことを指す。核酸医薬でよくみられる副作用は、タンパク質やRNAとの非特異的な結合に端緒するオフターゲット効果と考えられているが、分子メカニズムの詳細は未だ明らかになっていない。
(注2) 相補鎖
DNAやRNAに代表される核酸分子は、水素結合を介して二本鎖を形成できる能力を有する。一本鎖の核酸に結合する二本鎖目の核酸分子を相補鎖と呼ぶ。本研究のBROTHERS構造体では、ASOに結合する相補鎖を「弟鎖(Brother strand)」と命名している。
【利益相反の開示】
本研究成果に関する技術は本学よりリードファーマ社へ導出され、現在、治療薬開発が進められています。本研究成果に係る発明は、リードファーマ社に譲渡されています(国際出願番号:PCT/JP2022/036
699)。本論文の筆頭著者並びに責任著者はリードファーマ社の社員ならびに役員の身分を有しています。本研究はリードファーマ社からの資金提供を受けて実施されたものではありません。






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員