2025年03月11日
エボラウイルス粒子の「中核」構造を解明 ―VP24タンパク質の異なる結合様式がウイルス増殖制御のカギに―
長崎大学熱帯医科学研究所ウイルス学分野 髙松 由基 准教授、胡 上帆 助教の研究グループは、京都大学医生物学研究所 野田 岳志 教授(兼:京都大学大学院生命科学研究科 教授)、藤春(藤田)陽子 同日本学術振興会特別研究員(現:マックスプランク生化学研究所博士研究員)、杉田 征彦 准教授(兼:京都大学白眉センター)と共同で、ウイルスの内部構造を高精度で観察できる最新の電子顕微鏡技術を使用して、エボラウイルスの「中核」をなす生体分子複合体(ヌクレオカプシド)の構造を明らかにしました。さらに、ヌクレオカプシド構成タンパク質であるVP24がウイルス増殖を制御する仕組みの一端を明らかにしました。
エボラウイルスはヒトに致死的な出血熱を引き起こします。ウイルスゲノムの合成や子孫ウイルス粒子の形成には、ヌクレオカプシドと呼ばれる巨大な螺旋状のウイルスゲノム-タンパク質複合体が必須ですが、ヌクレオカプシドの各構成タンパク質(NP、VP24、VP35)がどのように集合しヌクレオカプシドを形成するのかは、ほとんど明らかにされていませんでした。本研究グループは、最新のクライオ電子顕微鏡法を用いて、エボラウイルス様粒子内部に取り込まれたヌクレオカプシドの詳細な構造を明らかにすることに成功しました。
明らかになった構造から、2分子のVP24がそれぞれ異なる配置で2分子のNPに結合する一風変わった結合様式を見出しました。さらにVP24に変異を導入した機能解析により、それぞれのVP24がウイルスゲノムの合成やヌクレオカプシドの細胞内輸送など、ウイルス増殖環の異なるステップを調節する「分子スイッチ」として働くことを発見しました。本成果は、エボラウイルスの増殖メカニズムの理解を大きく進めるだけでなく、ウイルスの増殖を阻害する治療薬の開発に役立つものと期待されます。
本成果は、2025年3月10日に国際学術誌「Nature Communications」に掲載されました。
| ポイント |
● 中央アフリカや西アフリカに分布し、ヒトに重篤な出血熱を引き起こすエボラウイルスの「中核」をなす生体分子複合体(ヌクレオカプシド)の構造と、ウイルス増殖を制御する仕組みの一部を明らかに。
● 最新のクライオ電子顕微鏡法を用いて、エボラウイルス様粒子内部に取り込まれたヌクレオカプシドの詳細な構造を明らかにすることに成功。
● エボラウイルスの増殖メカニズムの理解を大きく進めるだけでなく、ウイルスの増殖を阻害する治療薬の開発に役立つものと期待。
 |
| 1.背 景 |
エボラウイルスは中央アフリカや西アフリカに分布し、ヒトに重篤な出血熱を引き起こします。フィラメント状のエボラウイルス粒子内部には、ウイルスゲノムRNAと数種類のウイルスタンパク質が螺旋状に集合して作られる「ヌクレオカプシド(注1)」と呼ばれる生体分子複合体が存在します。ヌクレオカプシドは、ウイルスゲノムの転写・複製や子孫ウイルス粒子への輸送・取り込みなど、ウイルスが細胞内で増殖する際に様々な役割を果たし、ウイルス増殖の「中核」を担う超分子複合体です。本研究グループはこれまで、ヌクレオカプシドの主要構成タンパク質がNP、VP24、VP35(注2)であることを明らかにしました(Noda et al. PLoS Pathog 2006)。さらに、エボラウイルスやその近縁ウイルス(マールブルクウイルスおよびリョビュウイルス)(注3)のNP-RNA複合体(ヌクレオカプシドのコア構造)を細胞から精製し、クライオ電子顕微鏡法(注4)と単粒子解析法(注5)を駆使して、それらの構造を高分解能で明らかにしました(Sugita et al. Nature 2018; Fujita-Fujiharu et al. Nat Commun 2022; Hu et al. PNAS Nexus 2023)。しかし、ヌクレオカプシドを細胞から精製することは非常に困難であり、他のヌクレオカプシド構成タンパク質がNP-RNA複合体とどのように結合しヌクレオカプシドを形成しているのか、その詳細は不明のままでした。
そこで本研究では、エボラウイルスとそっくりの構造を持つエボラウイルス様粒子(注6)を合成し、クライオ電子顕微鏡を用いた単粒子解析法により、エボラウイルス粒子内部に取り込まれたヌクレオカプシドの構造解析を行いました。
| 2.研究手法・成果 |
エボラウイルスは感染症法上もっとも危険度が高い一種病原体に分類されているため、ウイルスを使用した実験にはバイオセーフティーレベル4(BSL-4)実験施設が必要です。そこで本研究では、エボラウイルスのヌクレオカプシド構成タンパク質(NP、VP24、VP35)およびフィラメント状粒子構成タンパク質(GP、VP40)(注7)のみを培養細胞に発現させ、感染性を持たない安全なエボラウイルス様粒子を合成しました。エボラウイルス様粒子内のヌクレオカプシドの構造解析の結果、NP-VP24-RNA複合体の構造を4.6 Åの分解能で詳細に明らかにしました。
ヌクレオカプシドの中心にはNP-RNA複合体が螺旋状に存在し、ヌクレオカプシドの骨格を形成していました。興味深いことに、NP-RNA複合体の外側には、2つのVP24分子(VP24-1とVP24-2)が2つのNP分子(NP-1とNP-2)に対してそれぞれ異なる配置で結合するという、一風変わった結合様式が認められました(動画)。そこでこの結合様式がウイルス増殖に与える影響を明らかにするため、2分子のVP24と2分子のNPの間の各相互作用を壊すような変異を導入し、様々な機能解析実験を行いました。その結果、VP24-1がNP-1に結合するとウイルスゲノムの転写・複製が停止し、その後、VP24-2がNP-2に結合するとヌクレオカプシドが細胞内を長距離輸送され子孫ウイルス粒子形成に向かうことが明らかになりました。すなわち、2分子のVP24分子はウイルス増殖を段階的に調節し、ヌクレオカプシドを転写・複製モードからウイルス粒子形成モードへと切り替える分子スイッチとして働くことが示されました。
本研究成果は、エボラウイルスが細胞内で増殖する際にVP24がヌクレオカプシドの多様な機能を制御する分子メカニズムを構造学的に明らかにしたとともに、NPとVP24の相互作用を標的としたウイルス増殖阻害薬の開発につながることが期待されます。
| 3.波及効果・今後の予定 |
エボラウイルス病は、バイオテロや輸入感染症の観点から日本でも早急に対策を要するウイルス感染症のひとつです。しかし、エボラウイルスを用いた研究を行うにはBSL-4施設が必要であるため、その研究は十分には進んでいません。現在、エボラウイルス病に対して承認されている唯一の治療薬は、ウイルスの細胞侵入を阻害する中和抗体薬のみであり、6種存在するエボラウイルスのうち1種のエボラウイルスにしか効果を示しません。従って、中和抗体薬とは異なる標的・異なる作用機序の治療薬の開発が強く望まれています。
本研究では、BSL-4施設を要しないタンパク質発現系を用いて、エボラウイルス様粒子内に存在するヌクレオカプシドの構造を明らかにしました。さらにヌクレオカプシドの機能発現に重要な分子間相互作用を明らかにしたことで、その相互作用を阻害する治療薬開発への筋道を立てました。今後は本研究で得られた詳細な構造-機能相関情報を活用し、新規エボラウイルス病治療薬の開発へと展開することが期待されます。
| 4.研究プロジェクトについて |
本研究は、日本医療研究開発機構(AMED)(課題番号:25fk0108694h0002、24fm0208101j0008)、科学技術振興機構 CREST(課題番号:JPMJCR20HA)、日本学術振興会(Core-to-Core Program A: JPJSCCA20190008)、科学技術振興機構 創発的研究支援事業(課題番号:JPMJFR214S)、日本学術振興会 国際共同研究加速基金(課題番号:JP22KK0115)、京都大学ウイルス感染症・生命科学先端融合的共同研究拠点、東京大学医科学研究所国際共同利用・共同研究拠点、武田科学振興財団などの支援の下で実施されました。
<用語解説>
注 1 ヌクレオカプシド:
ウイルス粒子内部で、ウイルスゲノムRNAとウイルス核タンパク質などのウイルスタンパク質が集まって形成する分子複合体。ウイルスの増殖や感染に必須の機能を担う。
注 2 ウイルスタンパク質NP、VP24、VP35:
ヌクレオカプシドを構成する主要タンパク質。NPはウイルスゲノムRNAと結合し、ヌクレオカプシドのコアとなる螺旋構造を形成する。VP24とVP35はヌクレオカプシド形成に関与するだけでなく、インターフェロン抑制因子として機能する。
注 3マールブルクウイルスとリョビュウイルス:
エボラウイルスとともにフィロウイルス科に属するウイルス。マールブルクウイルスはエボラウイルスと同様にヒトを含む霊長類に致死的な出血熱を引き起こす。リョビュウイルスはヨーロッパのコウモリから分離されたフィロウイルスで、ヒトへの感染性や病原性は不明である。
注 4 クライオ電子顕微鏡法:
急速に凍結した試料を、低温を保ったまま撮影することのできる電子顕微鏡法。生体分子を自然に近い状態で観察できるという特徴がある。近年、カメラの高性能化や、画像解析法などの革新的な発達に伴って、基礎生物学・医学・薬学などの分野で重要な分子の構造が次々と明らかにされている。2017年には、クライオ電子顕微鏡法の開発に貢献した研究者にノーベル化学賞が授与された。
注 5 単粒子解析法:
電子顕微鏡像から観察対象である分子の三次元構造を再構築する手法の一つ。電子顕微鏡によって得られた二次元投影像から分子の画像をたくさん切り出し、三次元における分子の方向を計算して逆投影することで三次元構造を再構築する。
注6 エボラウイルス様粒子:
ウイルスの一部のタンパク質のみで構成され、増殖能を持たない粒子。本物のウイルスに似た外形や構造を再現でき、BSL-4施設を必要とせず基礎研究やワクチン開発に用いられる。
注7 ウイルスタンパク質GP、VP40:
脂質二重膜(エンベロープ)と共にウイルス粒子を構成するウイルスタンパク質。GPはウイルス粒子表面に存在する突起状のタンパク質で、細胞侵入を担う。VP40は脂質二重膜の内側に結合し、ウイルスの細長い形状(フィラメント状)を形成する。
<論文タイトルと著者>
タイトル:Structural basis for Ebola virus nucleocapsid assembly and function regulated by VP24 (VP24によって制御されるエボラウイルス・ヌクレオカプシドの形成および機能の構造的基盤)
著 者: Yoko Fujita-Fujiharu#, Shangfan Hu#, Ai Hirabayashi, Yuki Takamatsu, Yen Ni Ng, Kazuya Houri, Yukiko Muramoto, Masahiro Nakano, Yukihiko Sugita, Takeshi Noda (#: equal contribution)
掲 載 誌: Nature Communications DOI:10.1038/s41467-025-57236-4
<参考図表>
A. エボラウイルス様粒子の電子顕微鏡像
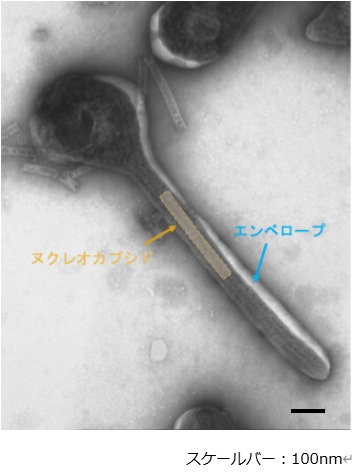 |
B. 本研究で明らかにしたヌクレオカプシドの構造。螺旋状ヌクレオカプシドは、同一構造の繰り返しにより形成されているため、その繰り返し構造「2分子のNP(NP-RNA)と2分子のVP24」のみを示している。2分子のVP24はそれぞれ2分子のNPと異なる位置で結合する。
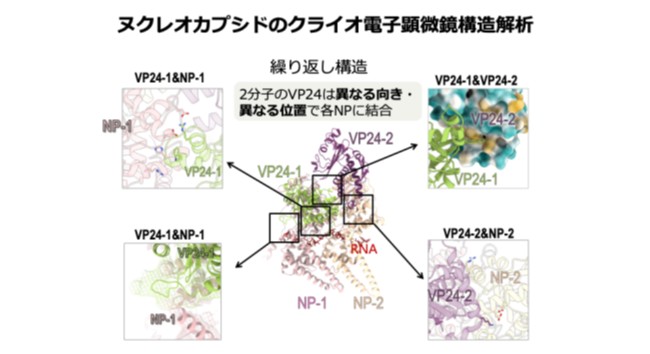 |
C. 2分子のVP24によるヌクレオカプシドの機能制御。VP24-1がNP-1に結合するとウイルスゲノムの転写・複製が停止し、次いでVP24-2がNP-2結合するとヌクレオカプシドが細胞内を長距離輸送され子孫ウイルス粒子形成に向かう。
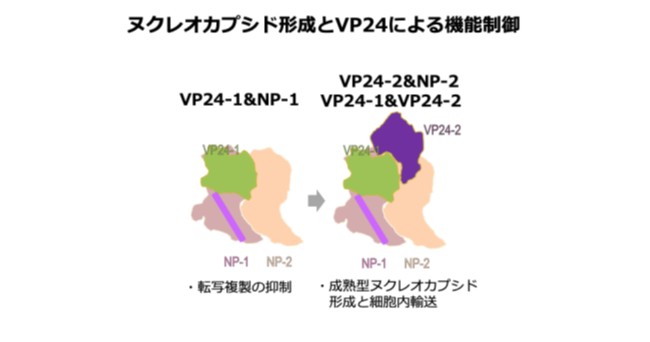 |






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員