2025年10月01日
エボラウイルスとマールブルクウイルスのヌクレオカプシド形成に共通するターゲットを発見—新たな抗ウイルス薬開発の可能性
長崎大学熱帯医学研究所ウイルス学分野 高松由基教授、京都大学医生物学研究所 野田岳志教授らの研究グループは、高病原性ウイルスの形成機構について先進のライブセルイメージングを用いて研究を行い、その成果が英文専門誌であるmBioに掲載されました。
エボラウイルス(EBOV)およびマールブルクウイルス(MARV)はフィロウイルス科に属し、ヒトを含む霊長類に致死的な出血熱を引き起こします。近年も中央アフリカや西アフリカでアウトブレイクを起こしていますが、これらウイルスに対する治療法は限定的です。
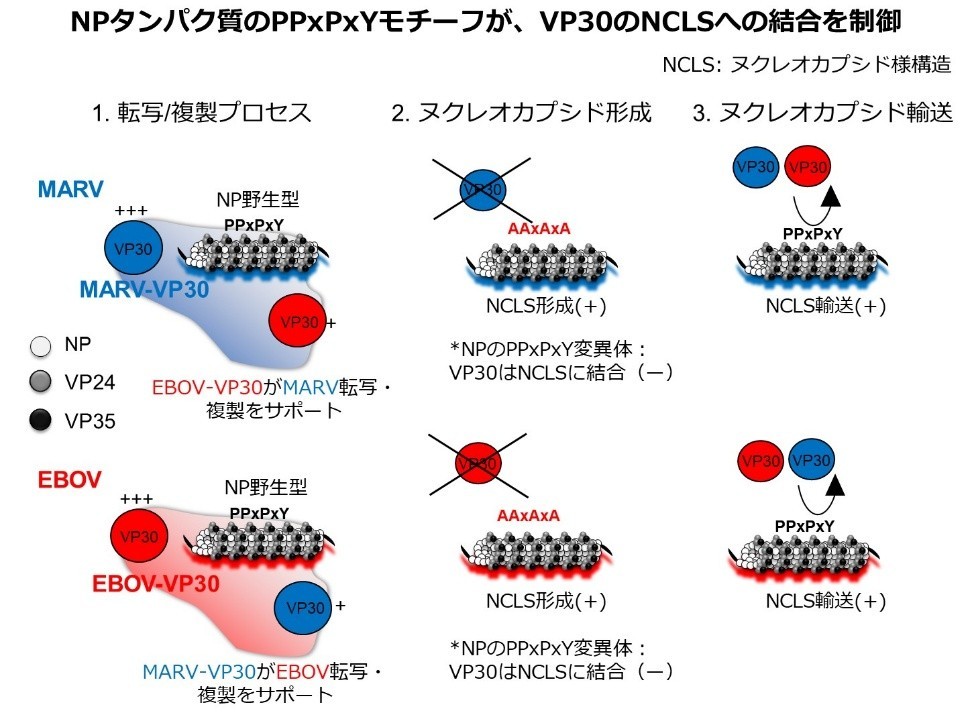
フィロウイルスのヌクレオカプシドは螺旋状のゲノムRNA-ウイルスタンパク質複合体で、ゲノムRNAの転写・複製を担います。本研究では、先進のライブセルイメージング技術を用いて、エボラウイルス(EBOV)とマールブルクウイルス(MARV)のヌクレオカプシド形成に関わる分子機構を解明しました。転写制御因子として知られるウイルスタンパク質VP30は、両ウイルス間で入れ替えてもヌクレオカプシドとともに機能し、転写・複製活性を発揮することがわかりました。
また、両ウイルスのNPタンパク質のC末端に存在するPPxPxYモチーフが、NP-VP30間の相互作用に不可欠であること、さらにVP30のヌクレオカプシドへの会合にも重要であることを明らかにしました。このモチーフはフィロウイルスで保存されているため、新たな抗ウイルス薬開発の標的となることが示唆されます。
本研究成果は、フィロウイルスのヌクレオカプシド形成機構の理解を深める重要な知見となるとともに、フィロウイルス感染症の新たな治療戦略の開発に寄与するものとなります。
|
図: MARVおよびEBOVにおけるヌクレオカプシド形成におけるNPのPPxPxYモチーフの役割 |
フィロウイルス感染細胞では、NPにより封入体(inclusion body)が形成され、ウイルスゲノムの転写・複製およびヌクレオカプシドの合成が起こる。VP30は異種NP形成封入体に共局在し、異種ミニゲノムの転写・複製機能をサポートする。
NPのPPxPxYモチーフの変異によりVP30はヌクレオカプシドに会合できなくなる。一方で、PPxPxYモチーフの変異によりヌクレオカプシドの輸送に変化は認められなかった。したがって、NP・VP35・VP24によりヌクレオカプシド構造が形成され、その間もしくはその後VP30が会合することが示唆された。
【論文情報】
雑誌名:mBio
題名:Molecular insights into nucleocapsid assembly and transport in Marburg and Ebola viruses
掲載日: 2025年9月22日
著者名:高松 由基1,2、オルガ ドルニク3、平林 愛4、岡本 健太5、蔵重 智美1、胡 上帆1、
小田 カタリナ春美1,6、野田 岳志4,7
1長崎大学 熱帯医学研究所 ウイルス学分野
2長崎大学 大学院医歯薬学総合研究科
3フィリップス大学マールブルク ウイルス学研究所
4京都大学 医生物学研究所 微細構造ウイルス学分野
5ウプサラ大学 細胞分子生物学部門
6長崎大学 熱帯医学・グローバルヘルス研究科
7京都大学大学院生命科学研究科 微細構造ウイルス学分野
責任著者:高松 由基
DOI: 10.1128/mbio.01557-25






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員